 Open Access
Open Access
ARTICLE
Impact des Thérapies Complémentaires sur la Survie de Patients Atteints d’un Cancer Traités par Chimiothérapie Orale dans un Établissement Hospitalier Français Spécialisé en Oncologie : Étude Exploratoire
Impact of Complementary Medicines on Survival in Patients with Cancer Treated with Oral Chemotherapy in an Oncology Hospital in France: Exploratory Study
1
Institut Desbrest d’Épidémiologie et de Santé Publique (Université de Montpellier-INSERM), Montpellier, 34298, France
2
Institut du Cancer de Montpellier, Montpellier, 34090, France
* Corresponding Author: Grégory Ninot. Email:
Oncologie 2022, 24(4), 605-612. https://doi.org/10.32604/oncologie.2022.024558
Received 02 June 2022; Accepted 07 September 2022; Issue published 31 December 2022
RÉSUMÉ
Une étude rétrospective observationnelle réalisée aux États-Unis montre une réduction de la survie de patients traités pour un cancer du sein, de la prostate, du poumon et colorectal en cas de déclaration d’usage de thérapies complémentaires (TC). Nous avons voulu vérifier ce résultat auprès d’une population française de 636 patients diagnostiqués des mêmes types de cancers et traités consécutivement par chimiothérapie orale dans un établissement hospitalier durant trois ans. Un entretien par un pharmacien en amont de l’administration d’une chimiothérapie orale a permis d’identifier les TC utilisées par les patients. Nous avons comparé la survie à partir d’un test du log-Rang en stratifiant les groupes (âge, sexe, nombre de cancers, nombre de comorbidités). Les résultats ne montrent pas de différence significative sur la survie entre le groupe de 191 patients déclarant utiliser des TC et le groupe de 445 patients déclarant ne pas en utiliser (p = 0.126). L’analyse descriptive des 256 pratiques complémentaires suggère que les patients français utilisent les TC quasi-exclusivement pour atténuer les symptômes associés au cancer et les effets secondaires des traitements antinéoplasiques, et non comme des médecines alternatives comme l’envisage l’étude américaine.Abstract
A retrospective observational study carried out in the United States showed a decrease in survival in patients treated for breast, prostate, lung and colorectal cancer with complementary medicines. We verified this result with a French population of consecutive 636 patients diagnosed with the same cancer and treated with oral chemotherapy in an hospital for three years. An interview by a pharmacist before the administration of oral chemotherapy was made to identify the complementary medicines used by the patients. We compared the overall survival using a log-rank test by stratifying the groups (number of cancers, number of comorbidities, age, sex). The results show no significant difference in survival between the group of 191 patients declaring that they use complementary medicines and the group of 445 patients declaring that they do not use (p = 0.126). A descriptive analysis of the 256 mentioned complementary medicines suggests that French patients use non-pharmacological interventions to alleviate cancer-associated symptoms and side effects of antineoplastic treatments, and not alternative medicine prompting patients to refuse conventional treatments compared to United States.MOTS CLÉS
Keywords
Plus de 85% des patients français utilisent au moins une « thérapie complémentaire » (TC) durant le traitement de leur cancer comme par exemple des plantes médicinales, des vitamines, des compléments alimentaires, des minéraux, des régimes, des massages, des pratiques psychocorporelles ou des médecines traditionnelles [1]. Il existe plus d’une centaine de termes pour désigner ces pratiques avec de nombreuses confusions entre approche, méthode et technique, des TC aux soins de support en passant par médecines douces, interventions non médicamenteuses, médecines alternatives et complémentaires ou encore soins non conventionnels [2]. Leur utilisation répond à une demande de réduction des effets secondaires des traitements, d’augmentation de l’autonomie, de participation active à la lutte contre leur cancer, d’amélioration de la qualité de vie [3,4] et, in fine, de se donner toutes les chances de guérir. Leur usage est amplifié par les incitations de la presse, les publicités, les réseaux sociaux et les associations de patients [5]. Des établissements hospitaliers spécialisés en oncologie intègrent certaines TC en tant que soins de support aux traitements anti-tumoraux.
Or, la littérature évoque l’influence délétère de praticiens de TC invitant les patients à utiliser des « remèdes naturels » dangereux [6] jusqu’à refuser des traitements biomédicaux conventionnels [7]. Cette hypothèse a été testée par une étude nord-américaine publiée au JAMA en 2018 [8]. Elle montre, par une analyse rétrospective d’une base de données de 1.901.815 patients touchés par un cancer du sein, du poumon, de la prostate ou colorectal et traités par au moins un traitement biomédical conventionnel (chirurgie, chimiothérapie, radiothérapie), que les 258 patients déclarant utiliser une TC ont une survie deux fois inférieure à ceux qui déclarent ne pas en utiliser. La population de 0,01% de patients déclarant utiliser une TC a été appariée selon un score de propension à 4 fois plus de patients n’utilisant pas de TC stratifiés sur des facteurs jugés cliniquement pertinents, l’âge, le type de cancer, le stade tumoral, le score de comorbidité Charlson-Deyo, le type d’assurance, l’ethnie et l’année de diagnostic. Avec l’évolution des traitements antinéoplasiques passant d’une voie d’administration en injection intraveineuse ou intramusculaire à l’hôpital à une voie orale à domicile, les risques de toxicité, d’interaction avec des TC [2,9] et de refus de soin augmentent. Notre étude rétrospective et exploratoire évalue l’impact sur la survie de l’usage déclaratif de TC chez des patients traités pour un cancer par chimiothérapie orale dans un centre d’oncologie français. L’objectif secondaire vise à recenser les pratiques complémentaires utilisées par les patients.
Nous avons exploité une base de données exhaustive et anonymisée de patients ayant réalisé un entretien pharmaceutique individuel dans un centre hospitalier de lutte contre le cancer avant la mise en œuvre d’une chimiothérapie orale. La période de recueil des données s’étendait de janvier 2018 à décembre 2020 inclus, soit 3 années complètes.
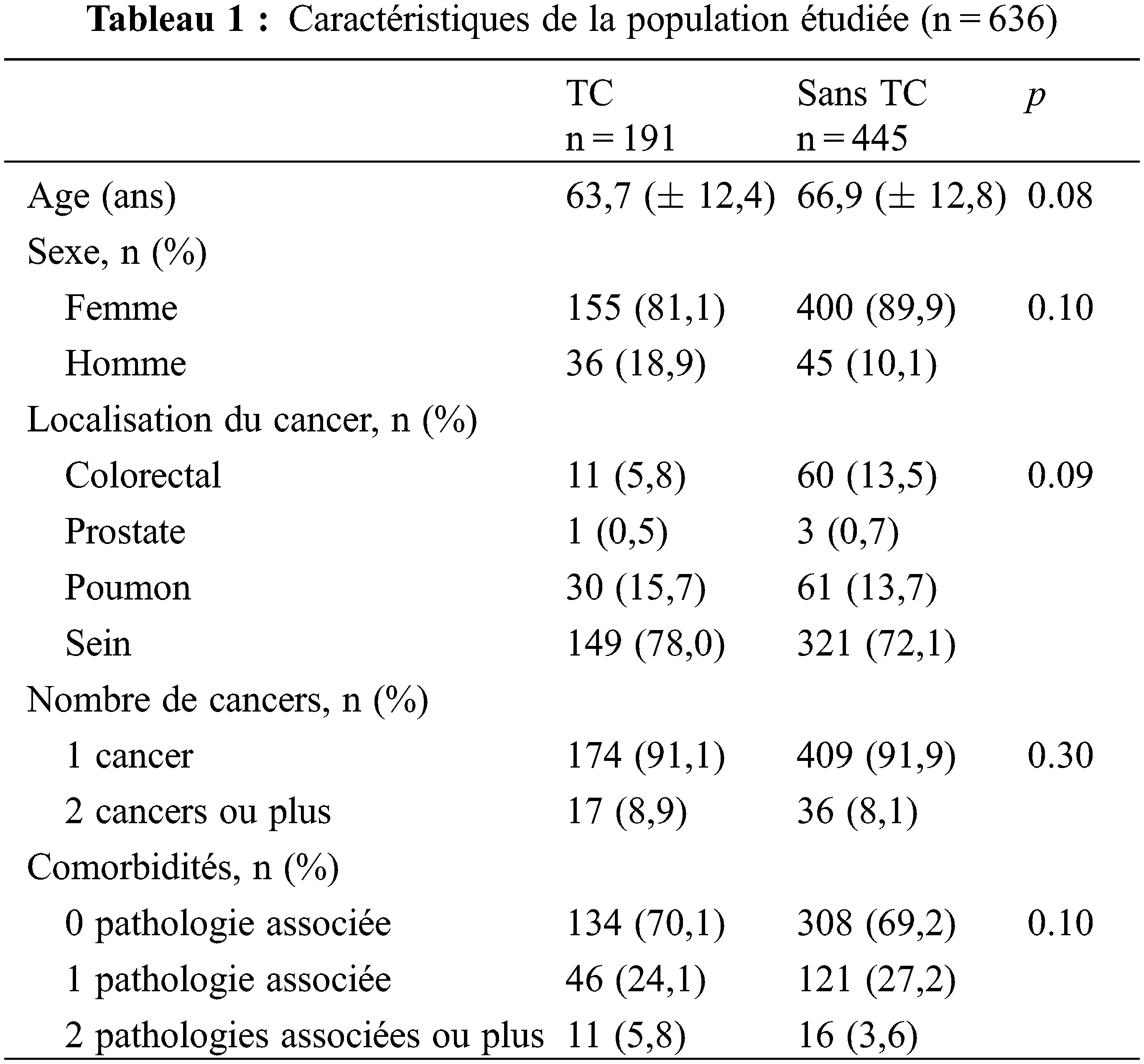
Les patients inclus devaient être un homme ou une femme de plus de 18 ans, allant être traité(e) d’un cancer du sein, de la prostate, du poumon ou colorectal par chimiothérapie orale. Les critères de non inclusion étaient un traitement par chimiothérapie injectable et une consultation pharmaceutique en période de suivi de la chimiothérapie orale. La base de données comporte 636 patients, dont 191 déclarant utiliser une TC et 445 déclarant ne pas en utiliser (Tableau 1), avec des valeurs statistiquement non différentes en termes d’âge, de sexe, de localisation du cancer, de nombre de cancers et de nombre de pathologies associées (Tableau 1).
Les données ont été extraites d’une copie anonymisée de la base de données hospitalière (date de naissance, sexe, localisation du cancer, nombre de cancers, nombre de comorbidité, date d’initiation de la chimiothérapie orale, date de décès). Les données déclaratives relatives à l’utilisation d’une TC ont été extraites d’une retranscription d’un entretien pharmaceutique individuel en face à face d’une durée de 15 à 30 min à l’hôpital précédant l’administration de la chimiothérapie orale. Ce pharmacien était formé à rechercher systématiquement tous les usages de TC et les indiquer dans une fiche individuelle de compte rendu. Toute mention de plante, minéral, champignon, complément alimentaire, régime, psychothérapie, médecine traditionnelle, nouvelle technologie, pratique psychocorporelle (…) a été recherchée dans chaque fiche individuelle par deux chercheurs, un médecin et un spécialiste des soins de support, de manière indépendante. En cas de désaccord, l’avis d’un troisième expert de la pharmacie ou de l’équipe de soin de support était demandé. La mention d’une seule TC a justifié l’inclusion du patient dans le groupe TC.
Les analyses ont été effectuées à l’aide du logiciel SAS 3.8. Un t de Student a été réalisé pour comparer l’âge entre le groupe TC et le groupe sans TC et un test de Khi-2 pour tester l’indépendance avec les facteurs de confusion. Nous avons analysé les liens entre l’usage déclaré de TC et la survie sous thérapie orale. L’événement étudié est le décès. La date associée au délai de survie est la date d’initiation de la chimiothérapie orale. Nous avons utilisé un test du Log-rank pour comparer les courbes de survie, puis la méthode non-paramétrique de Kaplan-Meier.
3.1 Inventaire des Thérapies Complémentaires Utilisées
Les 191 patients du groupe TC ont mentionné 256 termes relatifs aux thérapies complémentaires, se déclinant en ingrédients (e.g., « aubépine », « curcuma », « thé vert », « nigelle », « lapacho »), en remèdes naturels (e.g., « huile essentielle de lavande », « thé cannelle »), en produits de marque combinant des ingrédients (e.g., « Euphytose », « Circulymph ») et en approches globales (e.g., « médecine chinoise »). Au total, des termes relatifs aux plantes sous diverses formes (e.g., tisane, gélule, huile essentielle) ont été cités 176 fois (e.g., « desmodium », « millepertuis », « pissenlit », « gui », « aubépine », « cannabis », « passiflore », « gingembre », « bouleau », « bourrache », « pao pereira », « onagre »), 50 fois pour l’homéopathie (e.g., « arnica », « arsenicum »), 20 fois pour les compléments alimentaires (e.g., « spiruline », « gelée royale », « klamath », « vitamine C »), 4 fois pour les champignons (e.g., « levure de riz rouge », « levure de bière »), 3 fois pour les programmes nutritionnels (e.g., « jus de noni », « citron ») et 3 fois pour les médecines alternatives (e.g., « fleur de Bach », « magnétiseur »). Dans les plantes, il pouvait s’agir du bourgeon (e.g., « bourgeons de cassis »), de la graine (e.g., « graine de nigelle »), de la feuille (e.g., « feuilles de corossol », « menthe poivrée »), du pépin (e.g., « pépin de raisin »), du fruit (e.g., « pamplemousse »), de l’écorce (e.g., « aubier de tilleul ») ou de la racine (e.g., « radis noir », « racine de pervenche »). Ces plantes proviennent du monde entier, Europe (e.g., « persil », « pissenlit », « chicorée », « verveine », « tilleul », « lavande »), Afrique (e.g., « rauwolfia », « harpogophytum »), Asie (e.g., « ylang-ylang », « hamamélis »), Amérique du Sud (e.g., « moringa », « quassia amara »), Amérique du Nord (e.g., « corossol »), Océanie (e.g., « eucalyptus »), Indonésie (e.g., « garcinia »).
Il est à noter que 17,2% des patients qui ne prennent pas de TC ont une pathologie associée contre 9,1% pour le groupe TC. Pour la survie globale, la Fig. 1 présente les délais de survie selon la méthode de Kaplan-Meier dans la population, sans différence significative entre les groupes. La survie moyenne était de 2,1 ans (écart-type = 0,3), avec 142 décès sur un temps de suivi moyen de 2,1 ans (38 décès dans le groupe TC et 104 dans le groupe sans TC).
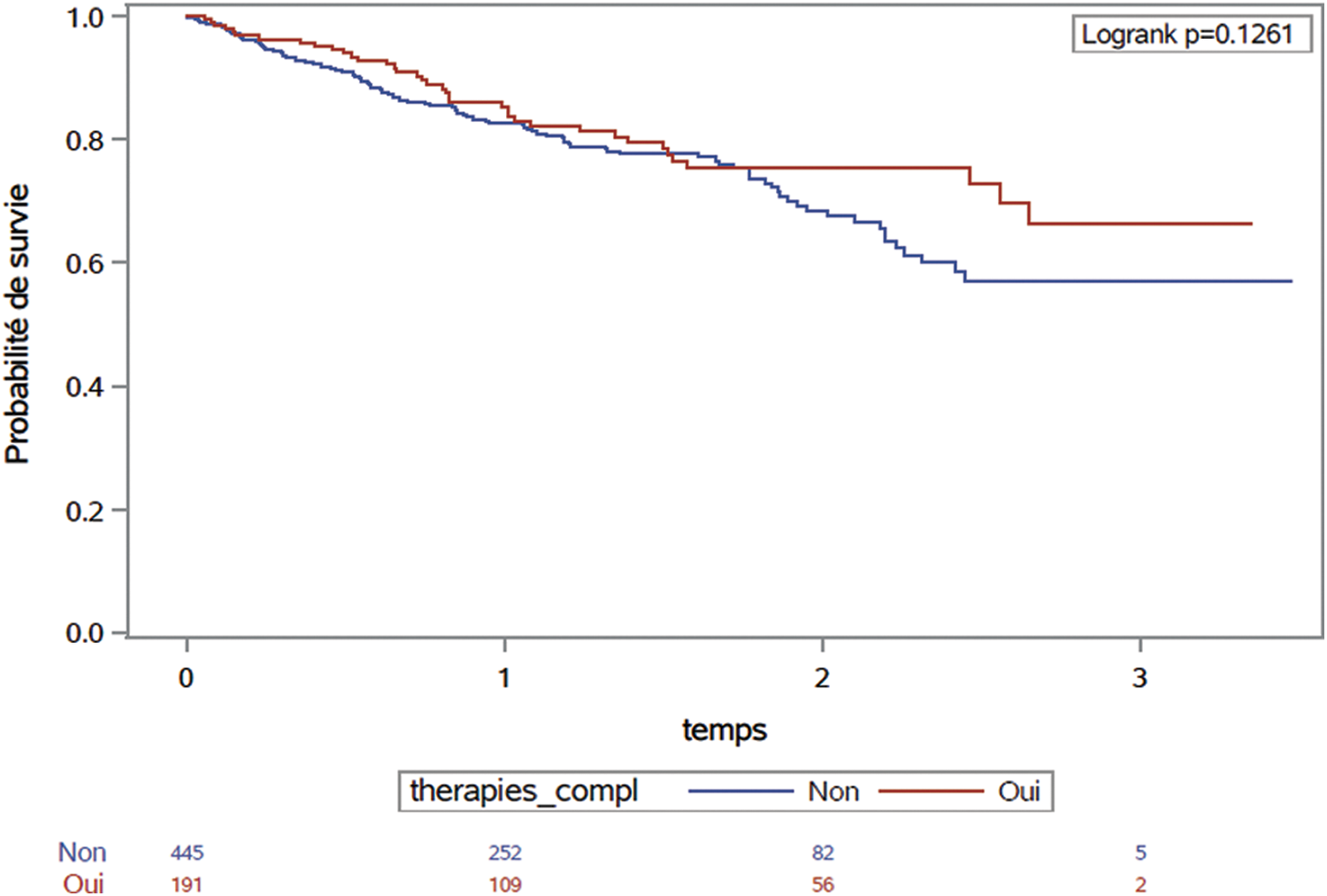
Figure 1: Courbe de survie globale en cas de déclaration d’usage ou non de thérapie complémentaire (méthode de Kaplan-Meier)
Cette étude exploratoire et rétrospective visait à vérifier les résultats d’une étude américaine montrant un risque de décès prématuré chez des patients traités pour un cancer du sein, de la prostate, du poumon ou colorectal en cas d’usage de TC [8]. L’essor de ces soins complémentaires est manifeste en France, en particulier dans le domaine de l’oncologie [2,8]. Les résultats chez 191 patients déclarant utiliser des TC comparés à 445 patients déclarant ne pas en utiliser entre 2018 et 2020, ne montrent pas de différence statistique significative sur la survie. L’analyse descriptive révèle une diversité d’ingrédients, de pratiques et d’approches, essentiellement à visée de réduction symptomatique (douleur, fatigue, nausées, trouble anxio-dépressif, alopécie…), d’amélioration de l’état général de santé (sommeil, condition physique, musculature…) et d’amélioration de la qualité de vie (bien-être, espoir, résilience…). Un seul cas sur 256 à visée curative du cancer selon un patient a été identifié (« fleur de Bach »). Notre étude étaye les résultats obtenus sur les mesures de qualité de vie de l’étude VICAN chez un public français [10]. De plus, une critique canadienne de l’étude américaine publiée en réponse sur le JAMA signale que les auteurs ont inclus uniquement des TC radicales conduisant les patients à refuser les traitements (e.g., mouvements sectaires, pratiques religieuses extrémistes) [11]. Les auteurs signalent d’ailleurs qu’une proportion supérieure dans le groupe TC refusait la chirurgie (7,0% contre 0,1%), la chimiothérapie (34,1% contre 3,2%), la radiothérapie (53,0% contre 2,3%) et l’hormonothérapie (33,7% contre 2,8%). L’article ne fait d’ailleurs aucune mention précise des dites pratiques de TC. Il est possible de penser que les auteurs ont finalement inclus dans leur groupe TC des patients embrigadés dans des pratiques médicales parallèles et/ou sectaires à visée alternative dans des régions spécifiques, en tout état de cause suivant des courants opposés à l’oncologie moderne et la médecine conventionnelle.
Notre étude questionne également la proportion de patients utilisant des TC, seules ou en combinaison. Les données relevées, via des entretiens en face à face avec un pharmacien avant la mise sous chimiothérapie orale indique que 30% des 636 patients utilisent une TC alors qu’une étude française par questionnaire auprès de 85 patients avançait le chiffre de 85% [1], et une autre celui de 83% auprès de 200 patients [12]. Notre proportion est plus proche des 40% obtenus dans une revue systématique [13]. L’étude VICAN auprès de 4174 patients indiquait une proportion de 21,4% [10]. Une traçabilité rigoureuse et systématique des pratiques complémentaires et des soins de support est nécessaire afin de mieux connaître les intentions d’usage et les usages réels, et ainsi mieux comprendre les bénéfices et les risques directs comme des toxicités ou indirects comme des interactions dangereuses et des pertes d’efficacité des traitements anti-tumoraux [2,14]. Les données scientifiques manquent pour informer correctement les patients sur les bénéfices et les risques de ces pratiques, et le cas échéant sur les précautions à prendre [2].
Notre étude se focalise sur les déclarations des patients au pharmacien hospitalier qui a, compte tenu de sa spécialité professionnelle, tendance à se centrer sur les plantes, les champignons, les aliments, les compléments alimentaires, les minéraux et les traitements homéopathiques. Il est possible que d’autres TC de type nutritionnel (e.g., régime diététique, jeûne thérapeutique), psychosocial (e.g., psychothérapie, pratique psychocorporelle, méthode d’art-thérapie), corporel (e.g., thérapie manuelle, méthode de kinésithérapie, programme d’activité physique, cure thermale, pratique de guérisseur, coupeur de feu, méthode énergétique) ou numérique (e.g., thérapies par réalité virtuelle, applications santé), aient été omises par les patients en pensant qu’elles n’auraient pas d’impact délétère au cours de la chimiothérapie orale [1]. Un croisement d’informations directes (e.g., participation à un programme de yoga) et indirectes (e.g., achat de complément alimentaire) provenant de plusieurs sources (e.g., praticiens hospitaliers, praticiens de ville, système de déclaration d’événements indésirables, retour d’expérience du patient et de ses proches) tout au long du parcours de soin va être nécessaire pour consolider les connaissances d’un champ aussi en expansion que famélique en termes de connaissances scientifiques [2].
Par ailleurs, la déclaration d’usage d’une TC à un professionnel de santé ne signifie pas nécessairement un usage réel. Un biais reste possible entre l’intention d’usage et l’usage réel. Nos résultats ne disent rien sur l’usage de TC au moment où des effets secondaires pourraient apparaître, ils tablent plus sur l’anticipation de ces troubles, et donc, un usage potentiellement préventif. Hélas, face à l’omerta autour de ces pratiques [4,5] et l’absence de traçabilité institutionnelle [2], des recherches restent à mener pour apprécier leur utilisation manifeste lors des traitements des cancers et les potentiels dommages sur la santé, sur la qualité de vie et sur la survie des patients.
Enfin, cette étude, comme l’américaine, s’appuient essentiellement sur une population de femmes traitées pour un cancer du sein. Une étude française indique 48% d’usage des TC dans les cancers pédiatriques [15]. Notre travail cible une seule phase du parcours de traitements des cancers, la chimiothérapie. Une étude française signale un usage de 43% lors d’une radiothérapie [16]. Nos résultats incitent à distinguer les populations et les phases de traitements, et à mieux tenir compte des facteurs susceptibles d’influencer l’usage de TC comme la gravité du cancer, le revenu, le niveau socio-éducatif et le lieu de résidence [8].
Notre étude exploratoire et rétrospective ne montre pas d’impact négatif sur la survie de l’utilisation des thérapies complémentaires déclarées à un pharmacien en amont d’une chimiothérapie orale d’un cancer du sein, de la prostate, du poumon ou colorectal. Comparés à une étude américaine ciblant ces mêmes cancers [8], les patients français semblent utiliser ces pratiques pour atténuer les symptômes associés au cancer et les effets secondaires des traitements antinéoplasiques et non pour essayer une voie thérapeutique alternative [8,17]. Ils paraissent ainsi vouloir se donner toutes les chances de mieux supporter les traitements, et finalement d’aller mieux [2]. L’étude conforte d’autres études françaises sur la fréquence d’usage et d’intention d’usage des TC, tout autant, que compte tenu de ses limites, elle encourage des recherches dans ce domaine au plus près des patients. Elle sensibilise les professionnels de santé à mieux prendre en compte ces pratiques et éviter leurs risques directs (e.g., effet secondaire d’un complément alimentaire, interaction délétère entre une chimiothérapie et une plante) et indirects (e.g., non observance de la thérapie orale à cause d’une surcharge de traitements). Ce travail encourage une meilleure traçabilité institutionnelle des TC, et non plus seulement des initiatives personnelles, de pharmaciens en l’occurrence. Ce suivi sera d’autant plus essentiel avec l’essor d’une oncologie intégrative voulant combiner des approches thérapeutiques et préventives [18], des démarches conventionnelles et non conventionnelles [19], et des soins hospitaliers et ambulatoires [20]. Le pire serait de faire coexister deux mondes parallèles sans partage d’informations conduisant à des errances diagnostiques et thérapeutiques, des pertes de chance et des abus comme le signale l’étude américaine [8].
Acknowledgement: Justine Liberkowski, Frédéric Pinguet, Dominique Granier, Pharmacie et Département des Soins de Support de l’Institut du Cancer de Montpellier, and SIRIC Montpellier Cancer.
Authorship: The authors confirm contribution to the paper as follows: study conception and design: Leenhardt, F., Perrier, L., Philibert, L., Ninot, G.; data collection: Leenhardt, F., Perrier, L., Philibert, L.; analysis and interpretation of results: Ninot, G., Guerdoux, E., Carbonnel, F., Faravel, K., Ismael, L., Leenhardt, F., Lognos, B., Perrier, L., Philibert, L., Tronc, B. Viala, M.; draft manuscript preparation: Ninot, G. All authors reviewed the results and approved the final version of the manuscript.
Ethics Approval and Informed Consent Statement: The study received an ethical approval of the IDESP, Montpellier, March 17, 2022.
Availability of Data and Materials: The readers can access the data used in the study contacting Ludovic Ismael.
Funding Statement: The authors received no specific funding for this study.
Conflicts of Interest: The authors declare that they have no conflicts of interest to report regarding the present study.
Références
1. Renet, S., de Chevigny, A., Hoacoglu, S., Belkarfa, A. L., Jardin-Szucs, M. et al. (2021). Risk evaluation of the use of complementary and alternative medicines in cancer. Annales Pharmaceutiques Francaises, 79(1), 44–52. DOI 10.1016/j.pharma.2020.05.001. [Google Scholar] [CrossRef]
2. Ninot, G. (2020). Non-pharmacological interventions: An essential answer to current demographic, health, and environmental transitions. Cham: Springer Nature. [Google Scholar]
3. Clarke, T. C., Black, L. I., Stussman, B. J., Barnes, P. M., Nahin, R. L. (2015). Trends in the use of complementary health approaches among adults: United States, 2002–2012. National Health Statistics Reports, 10(79), 1–16. [Google Scholar]
4. Richardson, M. A., Sanders, T., Palmer, J. L., Greisinger, A., Singletary, S. E. (2000). Complementary/alternative medicine use in a comprehensive cancer center and the implications for oncology. Journal of Clinical Oncology, 18(13), 2505–2514. DOI 10.1200/JCO.2000.18.13.2505. [Google Scholar] [CrossRef]
5. Lognos, B., Carbonnel, F., Boulze Launay, I., Bringay, S., Guerdoux-Ninot, E. et al. (2019). Complementary and alternative medicine in patients with breast cancer: Exploratory study of social network forum data. Journal of Medical Internet Research, 5(2), e12536. [Google Scholar]
6. Alsanad, S. M., Howard, R. L., Williamson, E. M. (2016). An assessment of the impact of herb-drug combinations used by cancer patients. BMC Complementary and Alternative Medicine, 16(1), 393. DOI 10.1186/s12906-016-1372-x. [Google Scholar] [CrossRef]
7. Greenlee, H., Neugut, A. I., Falci, L., Hillyer, G. C., Buono, D. et al. (2016). Association between complementary and alternative medicine use and breast cancer chemotherapy initiation: The breast cancer quality of care (BQUAL) study. JAMA Oncology, 2(9), 1170–1176. DOI 10.1001/jamaoncol.2016.0685. [Google Scholar] [CrossRef]
8. Johnson, S. B., Park, H. S., Gross, C. P., Yu, J. B. (2018). Complementary medicine, refusal of conventional cancer therapy, and survival among patients with curable cancers. JAMA Oncology, 4(10), 1375–1381. DOI 10.1001/jamaoncol.2018.2487. [Google Scholar] [CrossRef]
9. Lee, R. T., Kwon, N., Wu, J., To, C., To, S. et al. (2021). Prevalence of potential interactions of medications, including herbs and supplements, before, during, and after chemotherapy in patients with breast and prostate cancer. Cancer, 127(11), 1827–1835. DOI 10.1002/cncr.33324. [Google Scholar] [CrossRef]
10. Sarradon-Eck, A., Rey, D., Touzani, R., Mancini, J., Bendiane, M. K. et al. (2020). Use of non-conventional medicine and lifestyle change among cancer survivors: Evidence from the national VICAN survey. Journal of Cancer Survivorship, 14(6), 779–789. DOI 10.1007/s11764-020-00892-w. [Google Scholar] [CrossRef]
11. Carlson, L. E., Bao, T., Balneaves, L. G. (2019). Methodology flaws and implications of a complementary medicine study. JAMA Oncology, 5(3), 432. DOI 10.1001/jamaoncol.2018.6631. [Google Scholar] [CrossRef]
12. Gras, M., Vallard, A., Brosse, C., Beneton, A., Sotton, S. et al. (2019). Use of complementary and alternative medicines among cancer patients: A single-center study. Oncology, 97(1), 18–25. DOI 10.1159/000499629. [Google Scholar] [CrossRef]
13. Horneber, M., Bueschel, G., Dennert, G., Less, D., Ritter, E. et al. (2012). How many cancer patients use complementary and alternative medicine: A systematic review and metaanalysis. Integrative Cancer Therapies, 11(3), 187–203. DOI 10.1177/1534735411423920. [Google Scholar] [CrossRef]
14. Ernst, E. (2013). Thirteen follies and fallacies about alternative medicine. EMBO Reports, 14(12), 1025–1026. DOI 10.1038/embor.2013.174. [Google Scholar] [CrossRef]
15. Menut, V., Seigneur, E., Gras Leguen, C., Orbach, D., Thebaud, E. (2019). Utilisation des médecines complémentaires et alternatives chez l’enfant et l’adolescent atteint de cancer : Une pratique fréquente. Bull Cancer, 106(3), 189–200. DOI 10.1016/j.bulcan.2018.11.017. [Google Scholar] [CrossRef]
16. Dupin, C., Arsène-Henry, A., Charleux, T., Haaser, T., Trouette, R. et al. (2018). Prévalence et attentes de l’utilisation des « médecines alternatives et complémentaires » pendant la radiothérapie en 2016 : Étude prospective. Cancer Radiotherapie, 22(6–7), 682–687. DOI 10.1016/j.canrad.2018.06.016. [Google Scholar] [CrossRef]
17. Greenlee, H., Ernst, E. (2012). What can we learn from steve jobs about complementary and alternative therapies? Prevention Medicine, 54(1), 3–4. DOI 10.1016/j.ypmed.2011.12.014. [Google Scholar] [CrossRef]
18. Mao, J. J., Pillai, G. G., Andrade, C. J., Ligibel, J. A., Basu, P. et al. (2022). Integrative oncology: Addressing the global challenges of cancer prevention and treatment. CA: A Cancer Journal for Clinicians, 72(2), 144–164. DOI 10.3322/caac.21706. [Google Scholar] [CrossRef]
19. WHO (2014). WHO traditional medicine strategy: 2014–2023. Geneva. [Google Scholar]
20. Bagot, J. L., Theunissen, I., Mouysset, J. L., Wagner, J. P., Magné, N. et al. (2021). Integrative health care: Definition and examples of implementation in oncology in France. Rev d’Homéopathie, 12(4), e61–e66. DOI 10.1016/j.revhom.2021.10.007. [Google Scholar] [CrossRef]
Cite This Article
 Copyright © 2022 The Author(s). Published by Tech Science Press.
Copyright © 2022 The Author(s). Published by Tech Science Press.This work is licensed under a Creative Commons Attribution 4.0 International License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.

 Submit a Paper
Submit a Paper Propose a Special lssue
Propose a Special lssue View Full Text
View Full Text Download PDF
Download PDF Downloads
Downloads
 Citation Tools
Citation Tools