
 | Oncologie |  |
DOI: 10.32604/oncologie.2022.021250
ARTICLE
Le Cancer du Sein à Bobo-Dioulasso, Burkina Faso : Résultats de la Prise en Charge
Breast Cancer in Bobo-Dioulasso, Burkina Faso: Management Outcomes
1Service de Chirurgie Générale et Digestive, Centre Hospitalo-Universitaire Sourô Sanou (CHUSS), Bobo Dioulasso, 01 BP 676, Burkina Faso
2Service de Chirurgie du Centre Hospitalier Régional, Kaya, BP 230, Burkina Faso
3Département de Gynéco-Obstétricale et de la Médecine de la Réproduction (DGOMR) du CHUSS, Bobo Dioulasso, 01 BP 676, Burkina Faso
4Service D’anatomie Pathologique du CHUSS, Bobo Dioulasso, 01 BP 676, Burkina Faso
5Service de Chirurgie Viscérale du CHU Yalgado Ouédraogo, Ouagadougou, 03 BP 7022, Burkina Faso
*Corresponding Author: Ollo Roland Somé. Email: som_roll@yahoo.fr
Received: 04 January 2022; Accepted: 08 March 2022
Résumé: Introduction : La prise en charge du cancer du sein en Afrique subsaharienne est confrontée à des difficultés diagnostiques et thérapeutiques. Objectif : Décrire le profil clinique, thérapeutique et évolutif du cancer du sein au Burkina Faso. Patients et méthodes : Il s’agit d’une étude de cohorte rétrospective du 1er Juillet 2015 au 31 Décembre 2021 au CHU Sourô Sanou à Bobo Dioulasso, 2ème ville du Burkina Faso. Elle a porté sur les données cliniques, thérapeutiques et évolutives des cancers du sein, confirmés à l’histologie. Résultats : Nous avons colligé 368 cas de cancer du sein dont 8 cas chez l’homme (2%). L’âge moyen des patients était de 46,6 ± 12,1 ans [15–90]. Le délai moyen de consultation était de 23,9 ± 15,9 mois [2–60 mois]. Les tumeurs T4 étaient observées dans 77% (n = 283). Le carcinome infiltrant de type non spécifique prédominait (94,6%). Après le bilan d’extension, sur 326 patients les stades III et IV présentaient une fréquence de 45,7% (n = 149) et 41% (n = 134). Les données de l’examen immuno-histochimique notaient le sous-type triple négatif chez 18 patients sur 34 réalisations. La prévalence du VIH parmi les cas de cancer du sein était élevée (3%). La chirurgie a été réalisée chez 203 patients (55%). Il s’agissait d’une chirurgie curative chez 138 patients (37,5%). Parmi eux, 116 avaient reçu une chimiothérapie néo-adjuvante. La chirurgie a été radicale type mastectomie selon Madden dans 34,2% (n = 126/368), et conservatrice dans 3,3% des cas (12/368). La mastectomie de propreté a été faite chez 65 patients (17,7%). La radiothérapie a été réalisée dans 4,9% (n = 18) des cas. La survie globale à 3 ans et à 5 ans était de 50% et 22% respectivement. Les stades avancés étaient associés à une survie faible (p = 0,0001). Conclusion : Le cancer du sein est fréquent. L’âge jeune, le stade avancé et le sous-type triple négatif caractérisent le cancer du sein dans notre contexte. La survie est corrélée au stade et reste faible.
Abstract: Introduction: Breast cancer management in Sub-Saharian Africa, is faced with diagnosis and treatment challenges. This study aims to describe, breast cancers epidemiology in Bobo-Dioulasso, Burkina Faso. Patients and method: A retrospective cohort study was performed from July 01, 2015 to December 31, 2021 in the Souro Sanou university teaching hospital. Histologically confirmed breast cancer patients were included. Clinical aspect, treatment features and outcome data were collected and analyzed. Results: In study time, eight male’s cases (2%) 360 female’s cases among 368 breast cancers cases were included. The mean age was 46.6 ± 12.1 years, ranging from 15 to 90. The average duration of symptoms was 23,9 months. Tumors were mainly graded T4 (n = 283, 77%). Nonspecific invasive carcinoma represents 94,6% of histological subtypes. Stages III and IV represented respectively 47% (n = 149) et 43% (n = 134) of cases. Immunostains were available for 34 cases. Triple-negative breast cancer subtype was found in 52.9%. We found 3% of positive HIV among our breast cancer cases. Surgery was performed in 203 cases (55%). It was curative surgery in 138 cases. Surgical procedures were radical Madden’s mastectomy (34.2%) and breast conservative surgery (3.3%). In 65 cases, palliative breast surgery was realized. Only 5% of cases underwent radiotherapy. Overall survival at 3 and 5 years was 50% and 22%, respectively. The advanced stage was linked to poor survival (p < 0.00074). Conclusion: Breast cancer was frequent in our practice. It was associated with younger age, advanced stage, and triple-negative subtype in our context. Survival was poor. Population education and breast cancer screening implementation may allow improving early diagnosis and patient survival.
Mots clés: Burkina Faso; cancer du sein; stade; survie; traitement
Keywords: Burkina Faso; breast cancer; stage; survival; treatment
Le cancer du sein représente le premier cancer dans le monde avec plus de 11, 7% des cancers [1,2]. En termes de mortalité, il occupe la 5ème place des cancers dans le monde [1]. L’incidence du cancer du sein est plus importante dans les pays développés alors que dans les pays à ressources limitées (PARL), particulièrement en Afrique, la mortalité y est plus élevée [1,2]. Cette variabilité géographique des taux d’incidence et de mortalité rend compte des difficultés diagnostiques et thérapeutiques du cancer du sein dans les PARL [3,4]. On peut relever parmi les facteurs, essentiellement, l’absence de dépistage de masse, les pesanteurs socioculturelles couplées au faible niveau d’instruction et la disparité des ressources de prise en charge [1,3,4]. A l’instar des pays de l’Afrique subsaharienne, au Burkina Faso, le cancer du sein est caractérisé par son diagnostic tardif [5–7]. Sa prise en charge y est essentiellement chirurgicale du fait de l’inaccessibilité financière et ou géographique des autres moyens thérapeutiques telles que la radiothérapie et la chimiothérapie [3,5]. Les données sur le cancer du sein à Bobo Dioulasso sont inexistantes et souvent peu complètes dans la sous-région.
Dans le but d’améliorer la prise en charge du cancer du sein au Burkina Faso, nous avons entrepris cette étude qui a pour objectif de décrire le profil épidémiologique, clinique, thérapeutique et évolutif du cancer du sein dans notre contexte.
2.1 Type, Période et Lieu de L’étude
Il s’agit d’une étude de cohorte rétrospective. L’inclusion des patients a été faite du 1er juillet 2015 au 31 mai 2020. La survie des patients a été étudiée jusqu’au 31 Décembre 2021. Les services de gynécologie-obstétrique, chirurgie générale et digestive et d’anatomo-pathologie du centre hospitalier Sourô Sanou de la deuxième ville du Burkina Faso, ont servi de cadre et champs d’étude.
2.2 Patients, Paramètres étudiés et Collecte des Données
Ont été inclus, tous les patients suivis chez qui le diagnostic du cancer de sein a été prouvé histologiquement. Le croisement des données des différents registres a permis d’exclure les doublons. Un échantillonnage exhaustif de tous les cas de cancer du sein durant la période d’étude a été effectué.
Les données sociodémographiques comprenaient la fréquence, l’âge, le sexe, la résidence. Les données cliniques étudiaient le délai de consultation en mois, la notion d’antécédent familial, la taille tumorale définie comme une masse (>3 cm) ou un nodule (≤3 cm), la présence de la douleur et l’inflammation, le sein atteint, et la taille tumorale selon la classification TNM de la 8ème édition de l’Union Internationale pour le Contôle du Cancer (UICC). Les données paracliniques concernaient, la classification de l’American College of Radiology (ACR), les résultats de l’histologie, le grade SBR (Scarf-Bloom et Richardson), les données de l’immunohistochimie, et le stade selon l’UICC après un bilan d’extension par une tomodensitométrie thoraco-abdomino-pelvienne. Sur le plan thérapeutique les paramètres suivants ont été étudiés: la chirurgie appliquée et la morbidité, la chimiothérapie administrée, et la réalisation ou non de la radiothérapie. Les données évolutives ont apprécié la survie et le délai de suivi.
Les fiches de collecte ont été dûment renseignées à partir des registres de consultation des deux services, des dossiers médicaux existants, des comptes rendus opératoires et d’anatomie pathologique, des entretiens avec les patients et/ou leur famille.
2.3 Analyse et Tests Statistiques
Le seuil de significativité choisi était de 5%. La survie a été calculée par la méthode de Kaplan Meier et la comparaison des courbes de survie rendue possible par le test de Log Rank à partir du logiciel StatView version 4.55.
En cinq ans, 368 cas de cancer du sein ont été colligés soit une moyenne de 74 patients par an. L’âge moyen des patients était de 46,6 ± 12,1 ans. Les âges extrêmes étaient de 15 et 90 ans. Les patients de moins de 35 ans et de moins de 40 ans représentaient respectivement 61 cas (16,6%) et 110 cas (29,9%). Le sex-ratio H/F était de 0,02 avec 360 femmes (98%). Les femmes au foyer constituaient 81% des patients. Les patients provenaient d’un milieu urbain dans 70% des cas et dans 30% du milieu rural.
Le délai moyen de consultation était de 23,9 ± 15,9 mois avec les extrêmes de 2 et 60 mois. Trente-neuf patients soit 10,6% avaient des antécédents familiaux de cancer du sein. A l’examen sénologique les masses (tumeur > 3 cm) étaient retrouvées chez 49% des patients, suivi des nodules (≤ 3 cm) dans 47% des cas. Chez 30% des patients des douleurs étaient associées et une inflammation dans 21% des cas. Les lésions ont été retrouvées dans 49% des cas aussi bien dans le sein droit que dans le sein gauche. Dans sept cas, les lésions étaient bilatérales, synchrones chez cinq patientes et métachrones dans deux cas. Les lésions mammaires T4 selon la classification cTNM de l’UICC ont été retrouvées chez 283 patients soit 77% des cas (Tableau 1). Plus d’un cadrant étaient touchés chez 218 patients (59,2%).
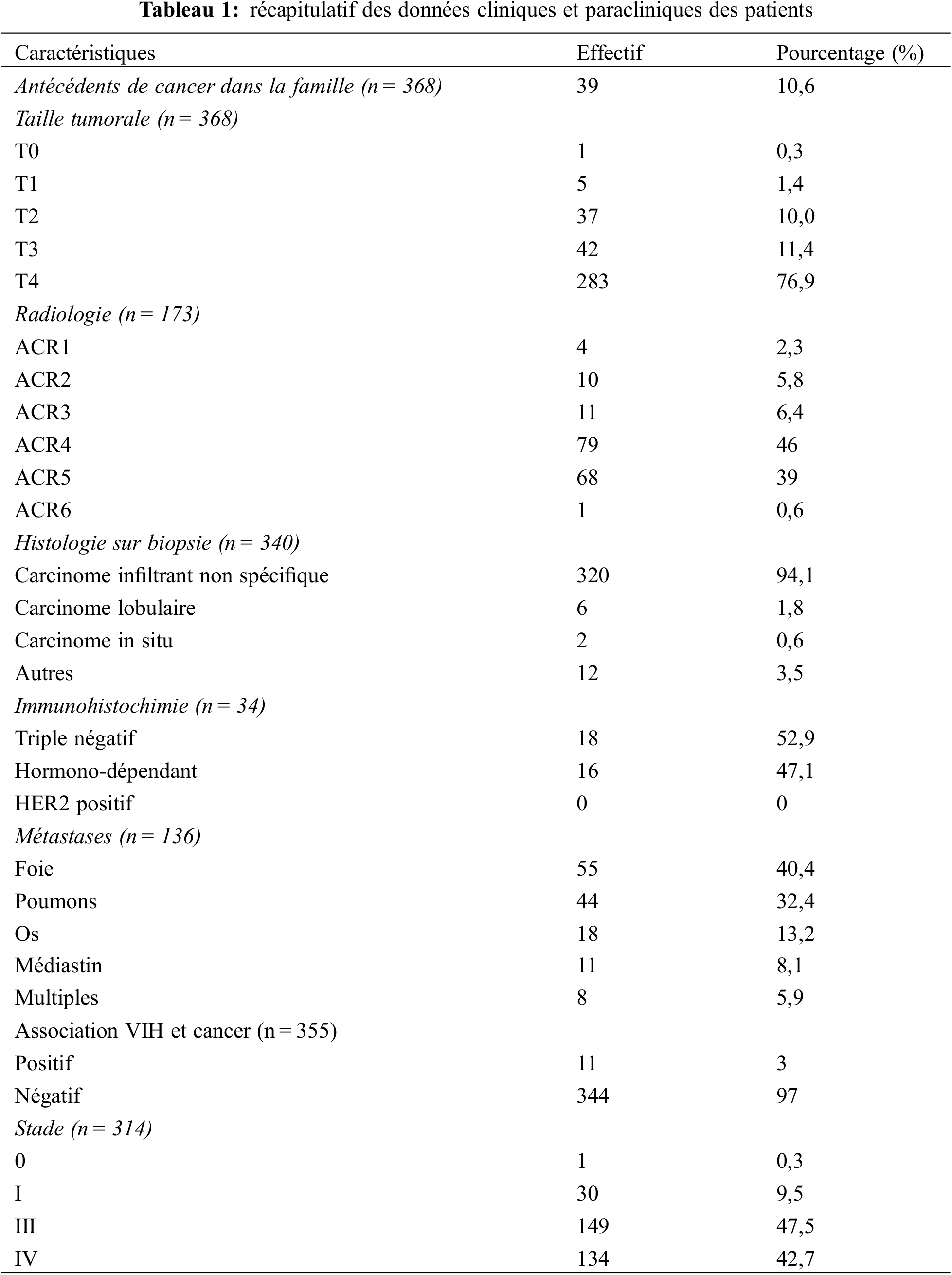
A l’imagerie (n = 173), les lésions ACR 4 et ACR 5 représentaient 46% et 39% des cas respectivement (Tableau 1). A l’histologie des pièces de biopsie, le carcinome infiltrant de type non spécifique a constitué 95,5% suivi du carcinome lobulaire infiltrant avec 1,8% (Tableau 2). Le grade histo-pronostique SBR a été précisé chez 109 patients. Les grades I, II et III représentaient respectivement 9%, 72% et 19%. L’examen immunohistochimique a été réalisé chez 34 patients soit un taux de réalisation de 9,2%. Le sous-type triple négatif a représenté 52,9% (n = 18) et les cancers hormono-dépendants 47,1%. Sur 326 patients qui avaient réalisé le bilan d’extension, 136 (41,7%) patients présentaient une localisation secondaire. Le foie était le site métastatique le plus fréquent suivi du poumon (Tableau 1). Les stades III et IV ont représenté respectivement 45,7%, (149 cas) et 41,1% (134 cas) (Tableau 1). Dans 11 cas on notait une association de cancer et VIH dont 7 cas à statut sérologique connu et suivi et 4 cas de découverte au cours du bilan pré-chimiothérapie.
3.4 Données Thérapeutiques et évolutives
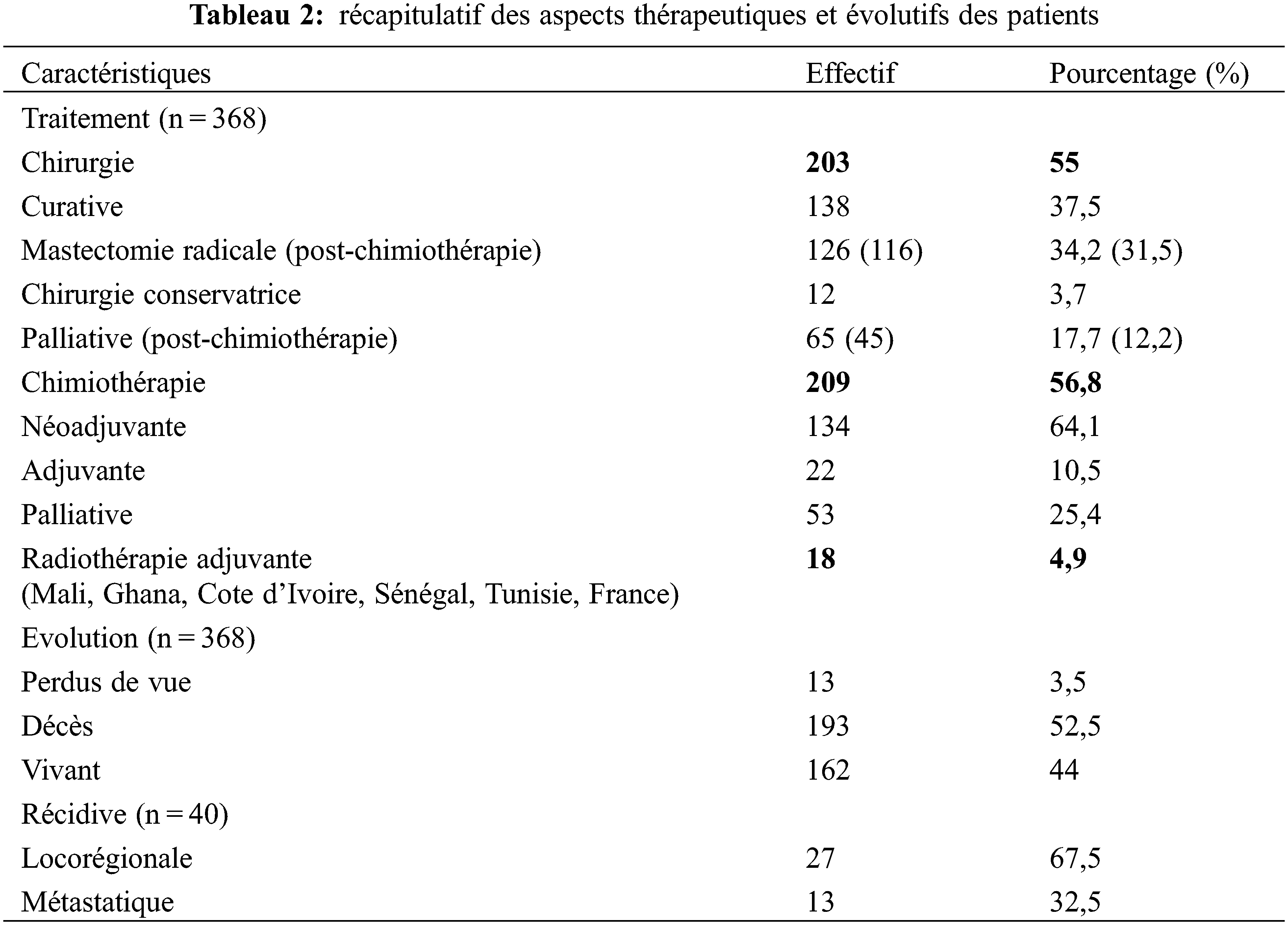
Sur le plan thérapeutique, 203 patients soit 55% ont bénéficié d’une chirurgie. Elle était à visée curative chez 138 patients soit 37,5% et palliative dans 17,7% des cas (n = 65). Nous avons pratiqué la chirurgie conservatrice chez 12 patientes (3,3%). Une mastectomie radicale selon Madden (Fig. 1) a été réalisée chez 126 patientes (34,2%).
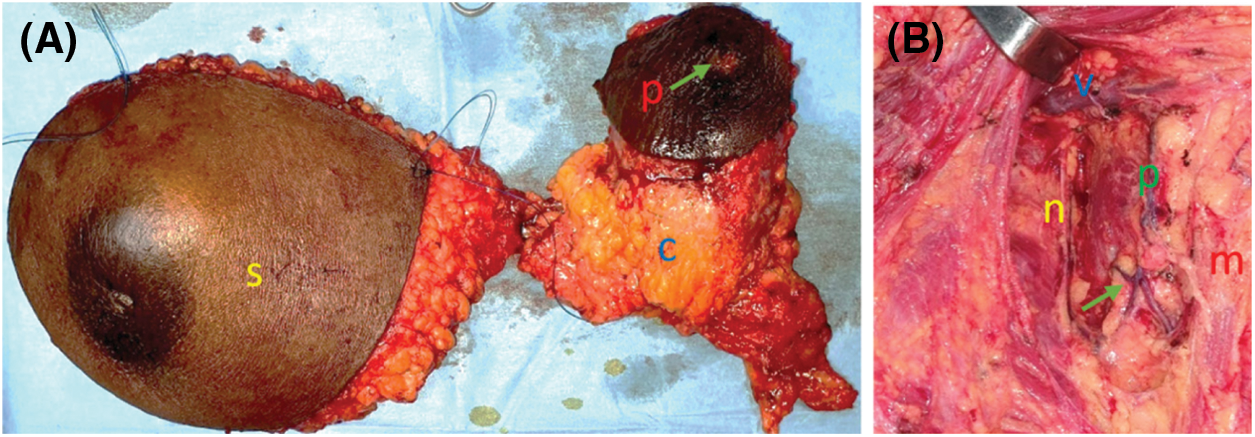
Figure 1: chirurgie radicale selon Madden. (A) pièce de mastectomie (s : sein avec une réponse clinique objective après la chimiothérapie à savoir la disparition de l’inflammation, la réduction de la taille tumorale de moitié ; c : produit du curage axillaire avec un paquet d’agglomérat ganglionnaire nécrotique surmonté d’une peau en regard (p) centrée par une zone fistuleuse (flèche). (B) limites du curage axillaire (en haut la veine axillaire (v), en dedans le nerf du long thoracique ou Charles Bell (n), en bas la bifurcation (flèche) du pédicule (p) subscapulaire et en dehors le bord antérieur du muscle grand dorsal (m)
Dans 31,5% des cas, la chirurgie était en post-chimiothérapie soit chez 116 patients (Tableau 2). Les marges de résection précisées chez 192 patients étaient saines dans 94,6% et R1 dans 11 cas. L’envahissement microscopique de la marge postérieure (moins 1 mm) était notifié dans 7 cas après mastectomie de propreté (épargnant les muscles pectoraux) et dans 4 cas selon Halsted. La chirurgie de ces cas R1 était réalisée en première intention dans 4 cas, et après chimiothérapie dans 7 cas. L’examen ganglionnaire post-opératoire avait été réalisé chez 102 patients. Le nombre moyen de ganglions prélevés était de 11 avec des extrêmes de trois et 29 ganglions. L’atteinte ganglionnaire avait été rapportée chez 84 patients soit 82,3%. Le nombre moyen de ganglions positifs était de 8,4. Il variait entre un et 28 ganglions. Soixante-quatorze patients avaient plus de trois ganglions atteints. La chimiothérapie a été réalisée chez 209 patients soit un taux de réalisations de 56,8%. Les protocoles utilisés en première intention étaient de manière séquentielle trois cycles de « FAC60 ou 50 » (association 5-Fluorouracil-Adriamycine-Cyclophosphamide), ou « AC » (Adriamycine-Cyclophosphamide) suivis de trois cycles de Docétaxel ou 12 cycles de Paclitaxel. La chimiothérapie était adjuvante dans 64,1% (n = 134) et palliative dans 25,4% (n = 53). La radiothérapie a été réalisée dans 4,9% (n = 18) (Tableau 2).
Sur le plan évolutif, la survie globale à 3 ans et à 5 ans était de 50% et de 22% respectivement (Fig. 2A). La médiane de la survie globale était de 36 mois La courbe de survie de patients jeunes de moins de 35 ans était sensiblement au-dessus de celle des patients de plus de 35 ans sans différence statistiquement significative (p = 0,3237) (Fig. 2B). Les taux de survie à 3 ans des stades localisés (I, II), localement avancé (III) et métastatiques (IV) étaient de 80%, 60%, 35% respectivement (p < 0,005) ((Fig. 2C). Le stade constitue un facteur pronostic de survie. Quarante cas de récidive sont survenus dans un délai moyen de 18 mois [3 à 54 mois]. Treize patients perdus de vue ont été notifiés (Tableau 2).
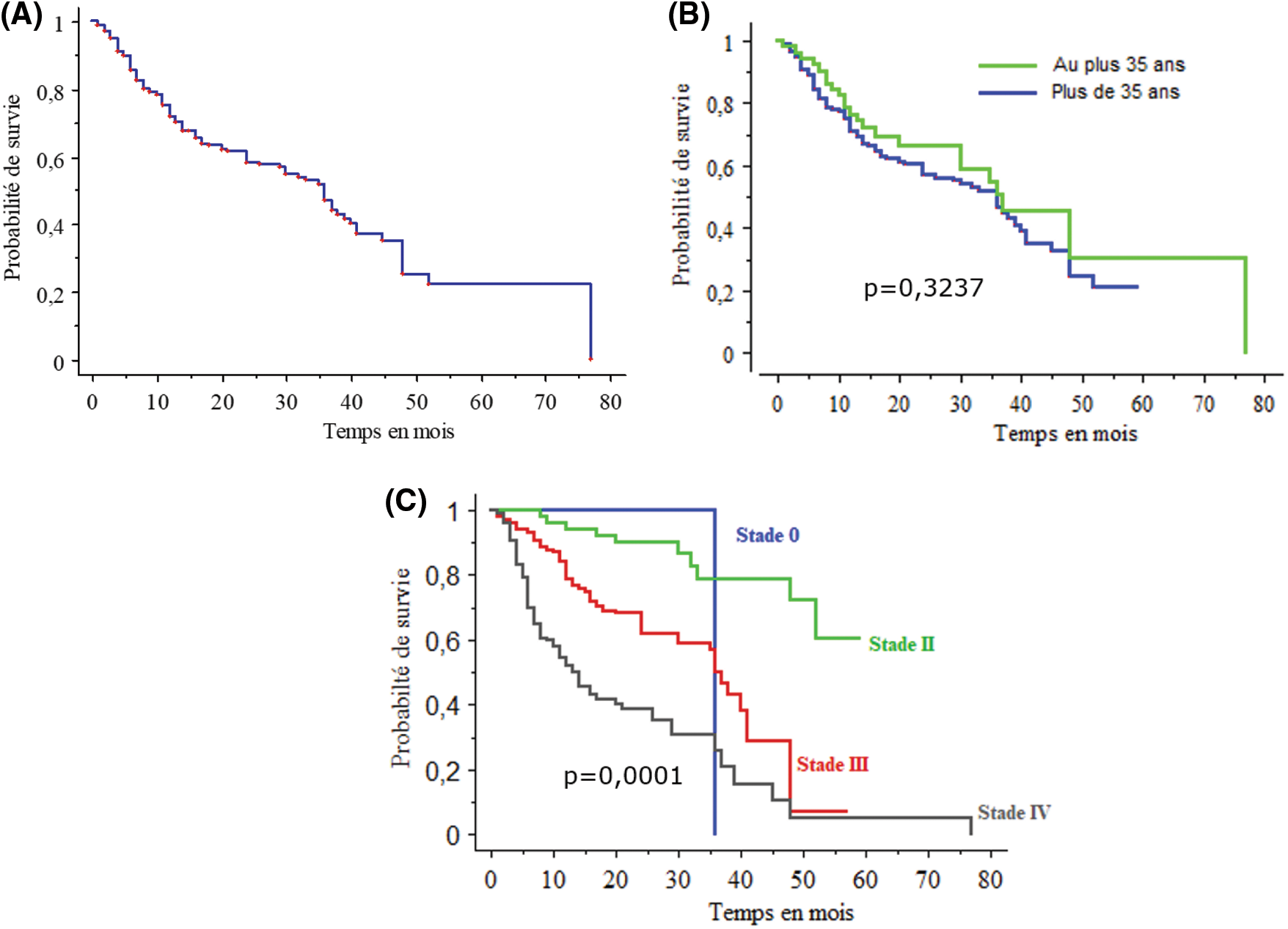
Figure 2: courbes de survie. (A) survie globale. (B) courbe de survie en fonction de l’âge <35ans et >35ans. (C) courbe de survie en fonction des stades
On ne notait pas de différence de la survie entre les patients opérés et non-opérés, la survie globale à 3 ans et 5 ans était respectivement de 71,1% vs. 72,1% ; 47,2% vs. 46,5% (Fig. 3A). Parcontre la courbe de survie des patients ayant bénéficié d’une chirurgie à visée curative (conservatrice ou radicale) est supérieure à celle des patients opérés pour un but palliatif (Fig. 3B).
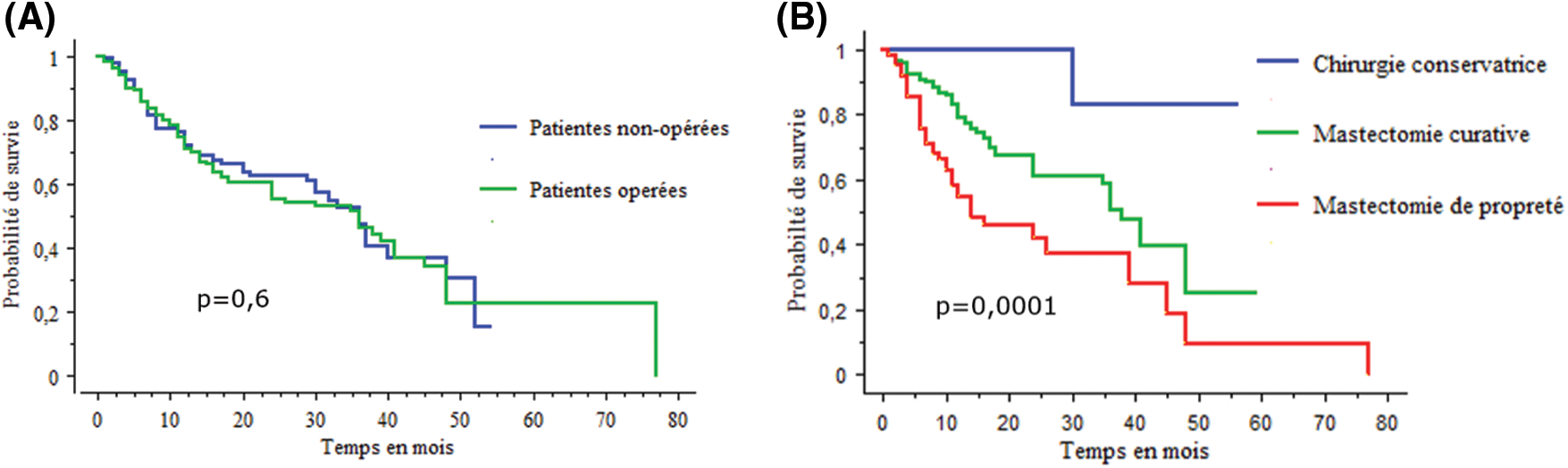
Figure 3: courbes de survie comparative des patientes opérées et non opérées (A) et des patientes selon le type de chirurgie (B)
En analyse univariée, plus la durée d’évolution est importante, moins est la survie (p = 0,6 ; n = 187). Dans notre étude, 0,1% de la survie est expliquée par l’âge, mais en générale l’âge avancé semble être un facteur de mauvais pronostique (p = 0,5). Le nombre de ganglions positifs lors du curage (le coefficient de détermination R2) permet d’expliquer 0,5% de la variation de la survie globale (Fig. 4).
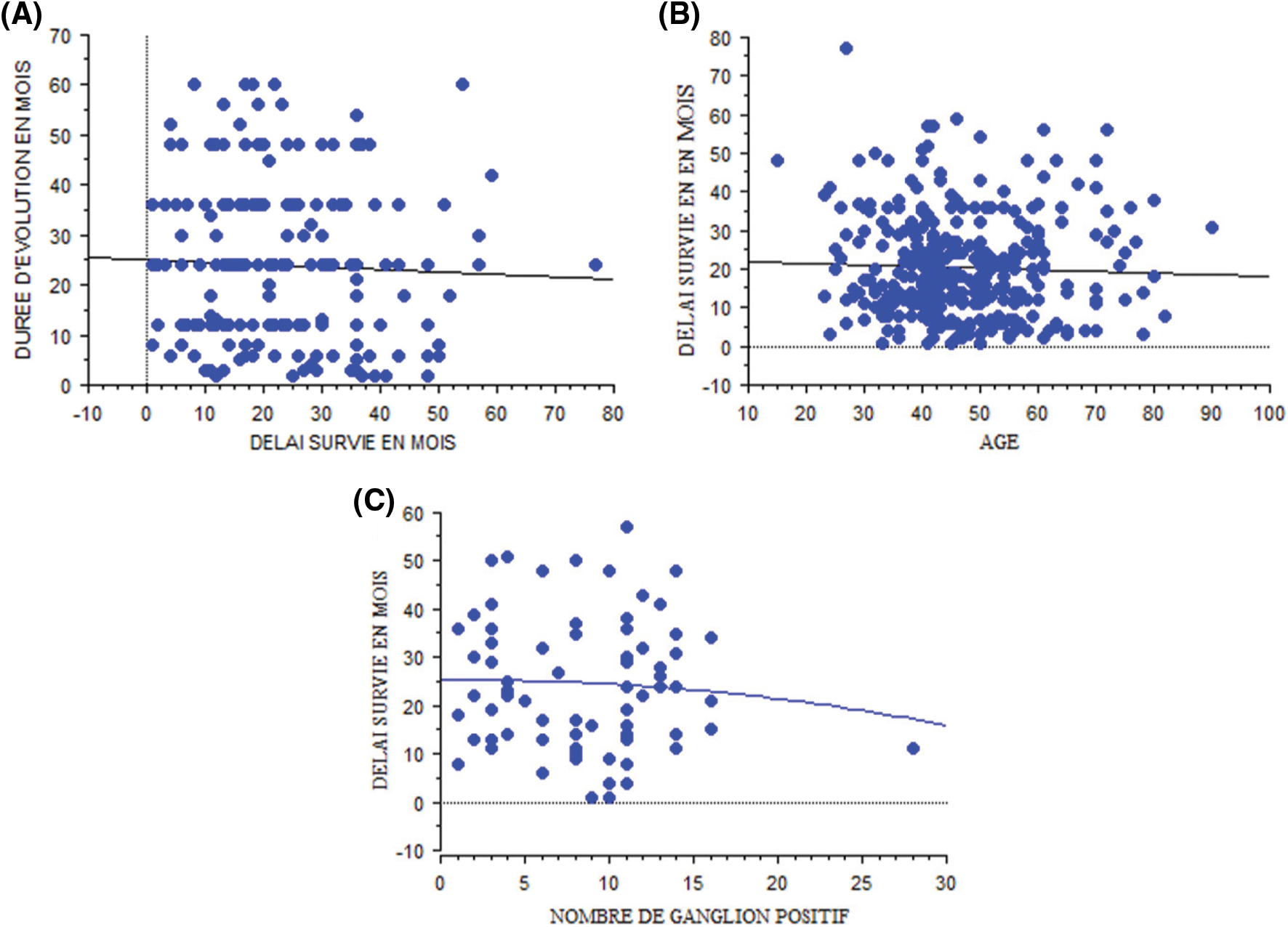
Figure 4: Graphique de régression: analyse univariée selon la durée d’évolution (A), l’âge (B), et le nombre de ganglions positifs (C)
En analyse multivariée, 3,1% de la variation de la survie est expliqué par la durée d’évolution du cancer, l’âge des patients, et le nombre de ganglions atteints ramenés après chirurgie. Ces variables varient inversement par rapport à la survie (âge = −0,092 (p = 0,8) ; durée d’évolution = −0,128 (p = 0,3) ; nombre de ganglions positifs = 0,075 (p = 0,8) et un terme constant de 30,9 (p = 0,02).
Le cancer du sein constitue le premier cancer de la femme dans le monde et au Burkina Faso [1]. Il représente le quart des cancers survenant chez la femme dans le monde [1,7]. Le nombre de cas annuel (74 cas) dans notre série est largement faible comparé aux données occidentales (48600 nouveaux cas en 2012 en France) [1,8]. Cela s’expliquerait en partie par le caractère monocentrique de notre étude. La meilleure connaissance du cancer du sein par les populations occidentales, le dépistage de masse organisé et centralisé ainsi que le développement des registres de cancer permettent de mieux expliquer cette large différence. L’occidentalisation progressive de nos sociétés (scolarisation grandissante avec première grossesse tardive, traitement hormonal substitutif, obésité et sédentarité) est de plus en plus observée. L’incidence du cancer du sein connaîtra une augmentation [2,3] en Afrique dans les années à venir alors qu’elle connaît déjà une baisse dans les pays développés [8].
Le cancer du sein est de loin un cancer féminin [1]. Sa survenue chez l’homme est rare. Une patiente sur dix avait une histoire familiale de cancer du sein dans notre série. En général le caractère familial du cancer du sein est rapporté dans 10 à 15% des cas et les gènes suppresseurs de cancer BRCA (1 et 2) mutés ne sont retrouvés que dans la moitié des cas [8]. Le risque de survenue d’un cancer mammaire dans ce cas est de 50 à 80% [8]. Les tests génétiques ne sont pas réalisés au Burkina Faso et en Afrique en général, d’où l’intérêt de la surveillance clinique et radiologique rapprochée des membres de famille des patients atteints de cancer du sein dans ce contexte.
Le jeune âge de survenue du cancer du sein s’intègrerait certes dans la jeunesse de notre population, mais suscite en plus la réflexion sur le rôle des gènes BRCA 1 et 2. Ce même constat était rapporté par plusieurs auteurs africains [4–6,9], alors qu’en France 80% des cas surviennent en post-ménopausique avec un pic situé entre 65–69 ans [1,8].
L’itinéraire thérapeutique des patients est fortement impacté par les croyances socio-culturelles sous-tendues par un faible niveau d’instruction de nos populations. L’ignorance de la curabilité du cancer du sein encore associé à la mort, la stigmatisation des patientes atteintes de cancer, la non pratique de l’auto-examen des seins, sont des facteurs concourant à rendre compte des longs délais de consultation fréquemment rapportés en Afrique sub-saharienne [3–4,6,9]. Cela expliquerait la prédominance des tumeurs de stades T3-T4 avec une atteinte ganglionnaire voire métastatique au moment du diagnostic telles que rencontrées dans notre contexte africain [4,6,9,10]. Le dépistage de masse organisé et centralisé effectif dans les pays occidentaux tarde à voir le jour en Afrique où les programmes nationaux de lutte contre le cancer sont encore embryonnaires [4]. Ce sont des organisations de la société civile qui mènent jusque-là des activités de prévention dans la lutte contre le cancer du sein. Cela a permis aux femmes de pratiquer de plus en plus l’auto-examen des seins et ainsi de consulter plus précocement.
Le taux de réalisation des mammographies à visée diagnostique est faible du fait du coût élevé (25000 XOF soit 38,10 EUR) pour la population démunie. La mise en œuvre de l’assurance maladie universelle en plus de pouvoir améliorer l’accessibilité aux examens à visée diagnostique, pourrait faciliter la réalisation de la mammographie de dépistage. Le plaidoyer des sociétés savantes et civiles serait d’un grand apport.
Le carcinome infiltrant de type non spécifique représente le type histologique des cancers du sein retrouvé dans la littérature [9,11,12]. L’immunohistochimie constitue une base pronostique et thérapeutique dans la prise en charge des cancers mammaires. Elle permet une prise en charge personnalisée du cancer du sein [11] afin d’optimiser le traitement tout en réduisant les effets démoralisants de la chimiothérapie. Son inaccessibilité géographique et financière justifie le taux faible de réalisation dans notre contexte [3,11]. Le cancer mammaire triple négatif prédominerait chez le sujet africain [11,12]. Ce sous-type est associé à une forte probabilité de mutation du gène BRCA, et à un mauvais pronostic [11]. Des études de génétiques permettraient de proposer un meilleur suivi oncogénétique des familles voire des mastectomies prophylactiques en cas de mise en évidence d’une mutation du gène BRCA.
La chirurgie constitue la pierre angulaire dans le traitement du cancer mammaire. Elle a connu une désescalade depuis sa description par Halsted [13]. La chirurgie conservatrice avec ou sans oncoplastie est largement indiquée en Europe tandis qu’en Afrique, la chirurgie radicale de type mastectomie avec curage axillaire d’emblée est fréquemment rapportée [4,5]. La prédominance des tumeurs T2, T3 et T4 avec envahissement ganglionnaire au diagnostic, la non vulgarisation de la technique du ganglion sentinelle et la disparité de la radiothérapie font que la chirurgie mammaire radicale (Fig. 4) reste la plus pratiquée [3,5]. Avec les différentes campagnes de dépistage et les efforts de communication des cancérologues, de plus en plus de cas précoces éligibles à une chirurgie conservatrice, devraient être rencontrés dans les années à venir.
Les indications de la chimiothérapie ont connu une avancée ces dernières années [14]. En plus de permettre un downstaging et un downsizing des tumeurs permettant de potentialiser les résultats de la chirurgie, la chimiothérapie néoadjuvante permettrait de rendre éligibles des patientes à une chirurgie conservatrice dans les pays à plateau technique élevé [14]. Le taux de réalisation de la chimiothérapie demeure faible du fait du coût des produits cytotoxiques inaccessible pour le citoyen moyen du Burkina Faso. En effet, le coût moyen d’une ordonnance s’élèverait à 80 000XOF(soit 122 EUR) hors mis le coût de l’administration qui varie d’une structure à une autre. Et le salaire moyen interprofessionnel garanti au Burkina Faso est environ de 30.000XOF. Des efforts de subvention sont donc nécessaires pour ainsi améliorer l’observance thérapeutique garant d’une bonne réponse. Du fait que l’étude ait lieu en zone d’endémie du VIH/SIDA, la sérologie est systématiquement demandée dans le cadre du bilan préthérapeutique (chimiothérapie ou chirurgie). La prévalence du VIH dans notre série est élevée par rapport à celle de la population générale (0,11%) [15]. Cette proportion élévée également observé dans la série de Traoré [16] en Guinée pourrait être un facteur de risque à étudier dans notre contexte. La radiothérapie était absente au Burkina Faso durant la période d’étude. Elle a été réalisée chez quelques patientes privilégiées dans des pays voisins disposant d’appareil de radiothérapie (Tableau 2). Elle est d’un grand apport dans le contrôle local du cancer du sein en améliorant la survie sans récidive et la survie globale [3,14]. La radiothérapie est la condition d’une chirurgie conservatrice [14]. Son avènement au cours de l’année 2021 dans notre pays permettra d’accroitre l’offre de conservation mammaire et une amélioration de la survie des patientes suivies pour cancer du sein.
La survie dans le cancer du sein en Europe est meilleure du fait des progrès thérapeutiques, de la sécurité sociale et du diagnostic précoce favorisé par le dépistage de masse centralisé [8]. En effet, la survie à 5 et 10 ans sont respectivement de 88% et 78% [8]. McCormack [7] rapportait une survie globale de 50% à trois ans dans une étude de cohorte prospective impliquant cinq pays d’Afrique subsaharienne (Afrique Sud, Namibie, Nigéria, Ouganda et la Zambie). En Namibie, la survie était meilleure au sein de la sous-population blanche (90% à 3 ans) tandis qu’au niveau la sous population noire Namibienne, elle chutait à 56% à 3 ans. Au Nigéria elle était de 36% à 3 ans [7]. Le stade au diagnostic représente un important facteur pronostique, mais aussi le niveau socio-économique, l’ignorance, le sous-type triple négatif [7]. La courbe de survie des moins de 35 ans est sensiblement supérieure à celle des patients de plus de 35 ans. Ceci pourrait être un biais de sélection. En effet il est décrit que l’âge jeune représente un facteur de mauvais pronostic [7,8]. L’analyse univariée et multivarié des facteurs pronostiques que sont l’âge, la durée d’évolution, le nombre de ganglions notent un impact de ces facteurs sur la survie, sans différence statistiquement significative.
Le cancer du sein est fréquent à Bobo Dioulasso au Burkina Faso. Il touche la femme adulte et jeune. Le diagnostic du cancer du sein dans notre contexte est tardif et est corolaire du mauvais pronostic. La chirurgie a une place de choix dans la prise en charge des cancers du sein au Burkina Faso. L’amélioration des résultats des traitements passe par un renforcement des ressources humaines et matérielles et une facilitation de leur accessibilité par la mise en œuvre de l’assurance maladie universelle. La sensibilisation et le dépistage du cancer du sein permettraient d’obtenir un diagnostic précoce. La mise en place d’un registre de cancer faciliterait une meilleure adéquation des programmes de lutte contre le cancer du sein au Burkina Faso.
Contribution des auteurs : Ollo Roland Somé (idée de l’étude, élaboration des objectifs, suivi de la collecte, plan d’analyse des résultats, rédaction de l’article, correction et soumission), Abdoul Halim Bagué (bibliographie, aide à la rédaction, établissement des courbes) Damien Konkobo (mise en forme et correction), Dieudonné Hien (collecte des données et analyse des résultats), Adama Dembélé(suivi de la collecte, correction), GL Hermann Bélemlilga (correction), Valentin Konségré (analyse des données histologiques, correction), Nayi Zongo (orientation de l’article, suivi de l’étude et correction de l’article.
Remerciements : Nous remercions les chefs de service du DGOMR (Pr Moussa Bambara, Pr Souleymane Ouattara, Pr Der Adolphe Somé) le chef de service de chirurgie générale (Pr Cyprien Zaré) et ses collaborateurs (Dr. Nassirou Yabré, Dr. Namory Keita) pour la facilitation de la collecte des données et leur collaboration dans la prise en charge des malades.
Financements : Les auteurs n’ont recus aucun financement pour cette étude.
Conflits d’intérêt : Les auteurs déclarent n’avoir aucun conflit d’intérêt à signaler concernant cette étude.
Considérations éthiques : Les Considérations éthiques et la confidentialité des données ont été respectées. Les autorisations auprès des différents responsables de l’hôpital ont été préalablement obtenues (No. MESRI/SG/UNB/INSSA/DPT-CHIR/2021-0004).
Disponobilté des données : Les données sont disponibles dans la base de collecte et les documents médicaux de l’hôpital et sont accesibles dans le respect de l’éthique et la confidentialité.
1. Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I. et al. (2020). Global cancer statistics: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. globocan2020. A Cancer Journal for Clinicians, 71(3), 209–249. DOI 10.3322/caac.21660. [Google Scholar] [CrossRef]
2. Jemal, A., Torre, L., Soerjomataram, I., Bray, F. (2019). The cancer atlas, Third ed. Atlanta, GA: American Cancer Society. [Google Scholar]
3. Ly, M., Antoine, M., André, F., Callard, P., Bernaudin, J. F. et al. (2011). Le cancer du sein chez la femme de l’Afrique sub-saharienne : État actuel des connaissances. Bulletin du Cancer, 98, 797–806. DOI 10.1684/bdc.2011.1392. [Google Scholar] [CrossRef]
4. Dem, A., Traoré, B., Dieng, M. M., Diop, P. S., Ouajdi, T. et al. (2008). Les cancers gynécologiques et mammaires à l’Institut du cancer de Dakar. Cahiers D’études et de Recherches Francophones/Santé, 18(1), 25–29. DOI 10.1684/san.2008.0093. [Google Scholar] [CrossRef]
5. Zongo, N., Millogo-Traore, T. F. D., Bagre, S. C., Bagué, A. H., Ouangre, E. et al. (2015). Place de la chirurgie dans la prise en charge des cancers du sein chez la femme au centre hospitalier universitaire yalgado ouedraogo : À propos de 81 cas. The Pan African Medical Journal, 22, 117. DOI 10.11604/pamj.2015.22.117.6929. [Google Scholar] [CrossRef]
6. Toure, M., Nguessan, E., Bambara, A. T., Kouassi, Y. K. K., Dia, J. M. L. et al. (2013). Facteurs liés au diagnostic tardif des cancers du sein en afrique sub-saharienne : Cas de la côte d’Ivoire. Gynécologie Obstétrique & Fertilité, 41, 696–700. DOI 10.1016/j.gyobfe.2013.08.019. [Google Scholar] [CrossRef]
7. McCormack, V., McKenzie, F., Foerster, M., Zietsman, A., Galukande, M. et al. (2020). Breast cancer survival and survival gap apportionment in sub-saharan Africa (ABC-DOA prospective cohort study. The Lancet Global Health, 8, e1203–e1212. DOI 10.1016/S2214-109X(20)30261-8. [Google Scholar] [CrossRef]
8. Sancho-Garnier, H., Colonna, M. (2019). Epidémiologie du cancer du sein. La Presse Médicale, 48, 1076–1084. DOI 10.1016/j.lpm.2019.09.022. [Google Scholar] [CrossRef]
9. N’Koua-M’Bon, J. B., Bambara, A. T., Moukassa, D., Gombé-Mbalawa, C. (2013). Caractéristiques cliniques et évolutives des cancers du sein inflammatoireà Brazzaville. Bulletin du Cancer, 100, 147–153. DOI 10.1684/bdc.2013.1700. [Google Scholar] [CrossRef]
10. Ba, D. M., Ssentongo, P., Agbese, E., Yang, Y., Cisse, R. et al. (2020). Prevalence and determinants of breast cancer screening in four sub-saharan african countries: A population-based study. British Medical Journal Open, 10, e039464. DOI 10.1136/bmjopen-2020-039464. [Google Scholar] [CrossRef]
11. Aka, E., Horo, A., Koffi, A., Fanny, M., Didi-Kouko, C. et al. (2021). Expérience africaine monocentrique de la prise en charge personnalisée des cancers du sein à abidjan : Défis et perspectives. Gynécologie Obstetrique Fertilite & Sénologie, 49, 684–690. DOI 10.1016/j.gofs.2021.03.001. [Google Scholar] [CrossRef]
12. Gnangnon, F., Takin, R., Gbessi, D., Ahomadegbe, C., Amidou, S. et al. (2020). Profil épidémiologique, moléculaire et pronostic du cancer du sein au sud de la République du Bénin. Revue d’Epidémiologie et de Santé Publique, 68(3), S138. DOI 10.1016/j.respe.2020.03.07. [Google Scholar] [CrossRef]
13. Jones, C., Landcaster, R. (2018). Evolution of opérative technique fo mastectomy. Surgical Clinics of North America, 98(4), 835–844. DOI 10.1016/j.suc.2018.04.003. [Google Scholar] [CrossRef]
14. Namer, M., Gligorov, J., Luporsi, E., Serin, D. (2005). « Cancers du sein » : Recommandations pour la pratique clinique de saint-paul-de-vence. Oncologie, 7, 342–379. DOI 10.1007/s10269-005-0243-8. [Google Scholar] [CrossRef]
15. ONUSIDA (2021). Rapport mondial d’avancement sur la lutte contre le sida. https://www.unaids.org/fr/resources/documents/2022/global-aids-monitoring-guidelines. [Google Scholar]
16. Traore, B., Diane, S., Sow, M. S., Keita, M., Conde, M. et al. (2015). Infection par le VIH chez les patientes atteintes de cancer du sein en guinée (Afrique de l’Ouest) [HIV infection in patients with breast cancer in Guinea (West Africa)]. The Pan African Medical Journal, 7(21), 261. DOI 10.11604/pamj.2015.21.261.7146. [Google Scholar] [CrossRef]
 | This work is licensed under a Creative Commons Attribution 4.0 International License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. |