
 | Oncologie |  |
DOI: 10.32604/oncologie.2021.019964
ARTICLE
L’acceptabilité du Patient Âgé Porteur de Cancer et la Tolérance à la Vaccination Anti-COVID-19 dans la Région Bretagne
Acceptability of Elderly Cancer Patients and Tolerance to COVID-19 Vaccination in the Brittany Region
1Unité de Coordination en Oncogériatrie de Bretagne, CHU Brest, 5 avenue Foch, Brest Cedex, 29609, France
2CHU Brest Morvan, 5 avenue Foch, Brest, 29200, France
3CHU Brest Cavale Blanche, Boulevard Tanguy Prigent, Brest, 29200, France
4CH Lannion, rue Kergomar, lannion, 22303, France
5CH Quimper, 14 avenue Yves Thépot, Quimper, 29000, France
6Clinique Pasteur-Lanroze, 32 rue Auguste Kervern, Brest, 29200, France
7CH Morlaix, 15 rue de Kersaint Gilly, Morlaix, 29600, France
8CH Saint Brieuc, 10 rue Marcel Proust, Saint Brieuc, 22000, France
9CH Saint Malo, 1 rue de la Marne, Saint Malo, 35400, France
10CRLCC Eugène Marquis Avenue de la Bataille Flandres-Dunkerque, Rennes, 35000, France
*Corresponding Author: Delphine Déniel. Email: delphine.deniel@chu-brest.fr
Received: 27 October 2021; Accepted: 15 December 2021
Résumé: Contexte : Depuis le 25 janvier 2021, la vaccination de la COVID-19 a pu être réalisée en France auprès des personnes âgées de 75 ans et plus. Les patients souffrant d’une maladie cancéreuse font partie des groupes à risque de développer des complications sévères à la COVID-19. Méthode : L’Unité de Coordination en Onco-Gériatrie région Bretagne a souhaité mettre en place une enquête sur l’acceptabilité du patient âgé porteur de cancer et sur la tolérance à la vaccination anti-COVID 19 dans la région Bretagne. Résultats : L’étude a été réalisée entre le 1er mai 2021 et le 31 août 2021 dans 7 centres bretons. 50 patients ont été inclus avec un âge médian de 84 ans (72–93). 43 patients au moment de l’inclusion avaient été vaccinés (80% ayant eu 2 injections et 8% une seule injection). Parmi eux, 86% ont déclaré avoir eu une très bonne tolérance à la première injection du vaccin et 90 % à la seconde injection. 12% des patients n’étaient pas vaccinés. Conclusion : Globalement, dans notre étude, les patients âgés porteurs de cancer ne présentaient pas de réticence à lavaccination anti-COVID19 et ont eu une très bonne tolérance à ces vaccins. Cependant, au vu du profil de ces patients et de la période d’inclusion, le nombre de patients présentant un schéma vaccinal complet aurait pu être plus conséquent.
Abstract: Context: Since January 2021, vaccination for COVID-19 has been made possible in France for people aged 75 and over. Patients suffering from a cancer disease are part of a group at risk to develop severe complications to COVID-19. Method: The « Unité de coordination en Onco-Gériatrie région Bretagne » (the Brittany Coordinating Unit in Onco-Geriatrics) has wished to set up an inquest about the acceptability and the tolerance to COVID-19 vaccination by old-aged patients suffering from cancer in the Brittany region. Results: The study has been carried out between May 1, 2021 and August 31, 2021 in 7 Breton centers. 50 patients have been included in the study with an average age of 84 (72-93). At the time of inclusion, 43 patients had already been vaccinated (80% having had 2 injections and 8% only one). Among them, 86% have declared they had had a very good tolerance to the first injection of the vaccine, and 90% to the second injection. 12% of the patients had not been vaccinated. Conclusion: Overall, in our study, old-aged patients suffering from cancer haven’t been reluctant to the anti-COVID-19 vaccination and have shown a very good tolerance to these vaccines. However, seen the profile of these patients and the period of inclusion, the number of patients showing a complete vaccinal outline should have been more consistent, indeed even total.
Mots clés: Vaccine; COVID; cancer; oncogériatrie; acceptabilité; tolérance
Keywords: Vaccine; COVID; cancer; oncogeriatry; acceptabllity; tolerance
Depuis le début de la pandémie à la COVID-19 (Coronavirus Disease 2019), plusieurs données ont démontré que les patients âgés ainsi que ceux atteints de cancer faisaient partie des groupes à haut risque de développer des formes sévères à la COVID-19 [1,2].
Tout comme les autres vaccinations recommandées pour les patients âgés présentant un cancer, la vaccination contre le SARS-CoV-2 est vivement conseillée, d’autant que les infections sont plus fréquentes mais aussi plus grave. L’immunosénescence, qui correspond à un état de dérégulation de la réponse immunitaire innée et adaptative survenant avec l’âge, joue un rôle important dans ce phénomène.
De plus, la pathologie cancéreuse ainsi que les traitements par chimiothérapie et la dénutrition aggrave le risque d’infection plus grave et plus sévère.
A partir du 18 janvier 2021, les patients âgés de 75 ans et plus ainsi que ceux traités pour un cancer ou une hémopathie maligne de moins de 3 ans, et en particulier en cours de chimiothérapie sont des populations prioritaires pour la vaccination contre le SARS-CoV-2 en France [3].
Courant mi-octobre 2021, plus de 84% de la population française âgée de 12 ans et plus possède un schéma vaccinal complet contre la COVID-19 [4]. D’après les données de la Direction de la recherche, des études, de l’évaluation et des statistiques (DREES), entre le 19 et le 25 juillet 2021, 87% des personnes admises en soins critiques et 83% de celles entrées en hospitalisation conventionnelle étaient non vaccinées [5]. L’efficacité de la vaccination anti-COVID a donc fait ses preuves pour prévenir les formes graves. Cependant au démarrage de la campagne vaccinale, une partie de la population française était réticente à la vaccination par peur de l’inconnu, des effets secondaires ; estimant qu’ils n’avaient pas suffisamment de recul en lien avec la rapidité de l’autorisation de mise sur le marché de chacun des vaccins… [6]. Mais qu’en est-il de la population âgée atteinte de cancer ?
Toutes les publications s’accordent sur l’importance de réaliser les vaccinations idéalement avant initiation d’une thérapie anti-cancéreuse. Pour les patients en cours de traitement anti-cancéreux, la notion la plus consensuelle est de ne pas vacciner les patients en phase d’aplasie [3]. Les recommandations vaccinales ne se subtituent pas à la connaissance de l’état clinique des patients atteints de cancer par les équipes médicales qui les suivent. La relation médecin/patient, dans le processus de décision partagée conduisant à la vaccination, reste essentielle [7].
En Bretagne, l’indice de vieillissement est supérieur à la moyenne nationale, avec de fortes disparités intrarégionales. Cependant, lors des deux premières vagues de la pandémie, la région Bretagne est l’une des celles qui a compté le moins de malades à la COVID-19. En moyenne, en France, 11% de la population a été infectée contre moins de 4% en Bretagne (au 06/12/2020) [1]. En parallèle, dès le début de la mise en place du plan vaccinal, la région Bretagne a obtenu un des meilleurs taux de vaccination par rapport au reste du pays [8].
Ainsi, dans un intérêt de santé publique, l’UCOG Bretagne (Unité de Coordination en Oncogériatrie) souhaite mettre en place une enquête sur l’acceptabilité du patient âgé porteur de cancer et sur la tolérance à la vaccination anti-COVID-19 dans la région Bretagne.
Il s’agissait d’une étude rétrospective multicentrique (avis du comité d’éthique du 19 avril 2021), réalisée dans 7 établissements de santé bretons. L’étude a été proposée, par le gériatre investigateur, aux patients convoqués lors d’une évaluation oncogériatrique personnalisée (EGP) par le biais d’une lettre d’information. Une fois que le gériatre réalisant l’EGP a attesté de la non opposition du patient à participer à l’étude, un premier formulaire était complété par le gériatre, sur les conditions de l’EGP, l’état général du patient, la tolérance à la vaccination de la COVID-19, la mise à jour de ses autres vaccins. Une seconde partie était complétée par l’infirmière de coordination de l’UCOG sur la nature de la tumeur, si le patient présentait des troubles cognitifs, son lieu de vie….et enfin le patient a complété un questionnaire directement sur son acceptabilité et la tolérance au vaccin quand celui-ci a été réalisé (annexe 1).
Les critères d’inclusion à cette étude étaient les suivants :
– Patient atteint d’une tumeur solide ou d’une hémopathie maligne nouvellement diagnostiqué (en situation néo-adjuvante, adjuvante ou métastatique)
– Patient de 70 ans et plus
– Patient ayant une évaluation gériatrique personnalisée (en consultation, en hôpital de jour, en hospitalisation continue ou réalisée par une équipe mobile gériatrique)
– Patient non inclus dans un essai thérapeutique interventionnel
– Patient n’ayant pas émis d’opposition à participer à l’étude
L’objectif de notre étude était d’établir un état des lieux de l’acceptabilité des patients âgés porteurs de cancer à se faire vacciner à la COVID-19 et d’évaluer la tolérance par rapport à cette vaccination.
50 patients ont été inclus par 9 investigateurs différents sur la période allant du 01/05/2021 au 31/08/2021.
74% des EGP ont eu lieu en consultation, 16% en hôpital de jour et 10% par une équipe mobile de gériatrie. La demande de l’EGP a été formulée dans le cadre d’une réalisation d’une chimiothérapie intraveineuse/immunothérapie à 28%, la réalisation d’une chirurgie à 20%, pas de formulation particulière à 18% (Fig. 1).
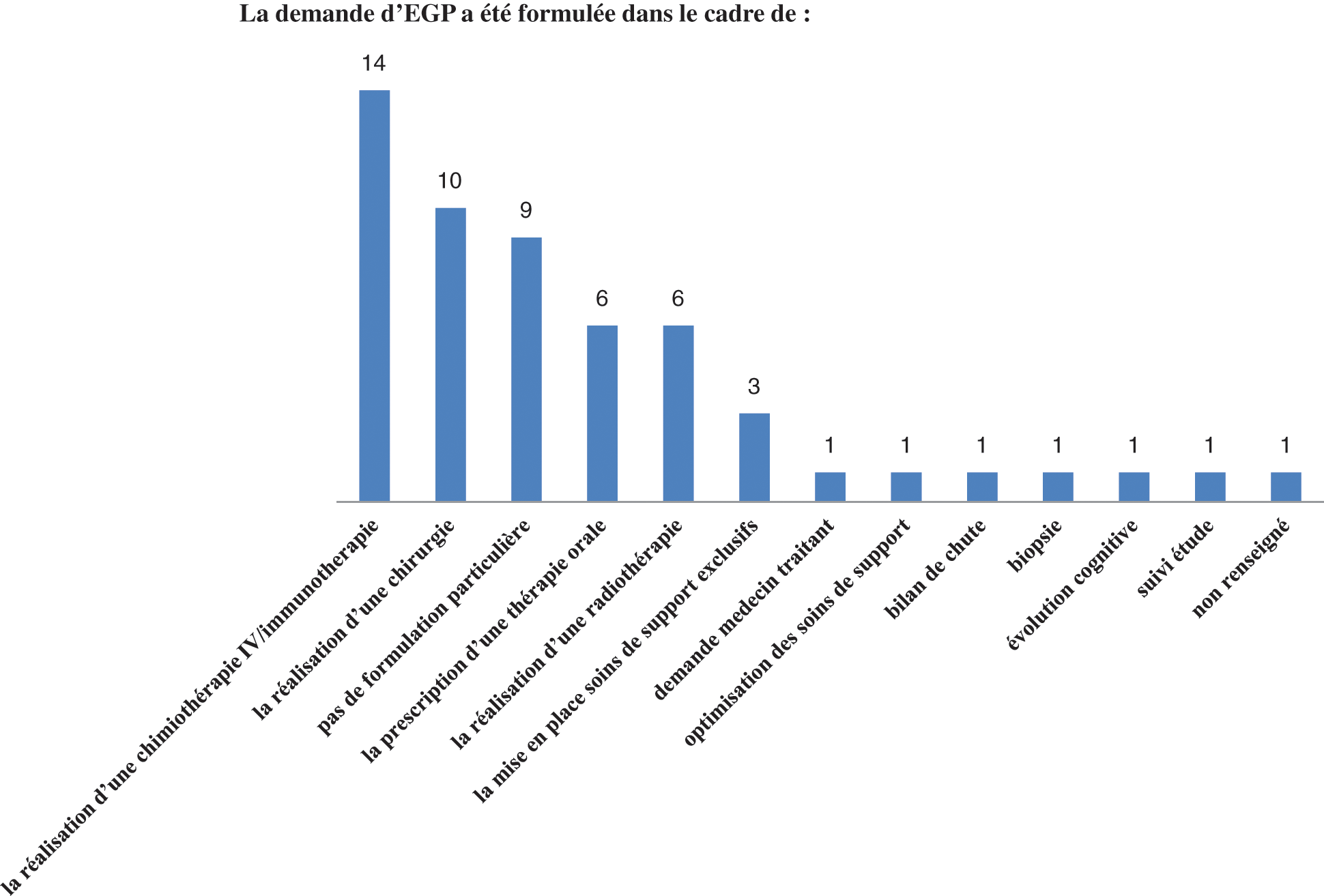
Figure 1: Cadre de la demande de l’EGP
Une grille G8/oncodage a été complétée préalablement à l’EGP pour 45% des patients, et pour 10% complétée au cours de l’EGP. Le score médian G8 des patients était de 13(4–15).
La médiane d’âge des patients était de 84 ans (72–93) avec 58% de femmes. Au moment de l’EGP, le performans status médian des patients était de 1 (0–4) (Fig. 2).
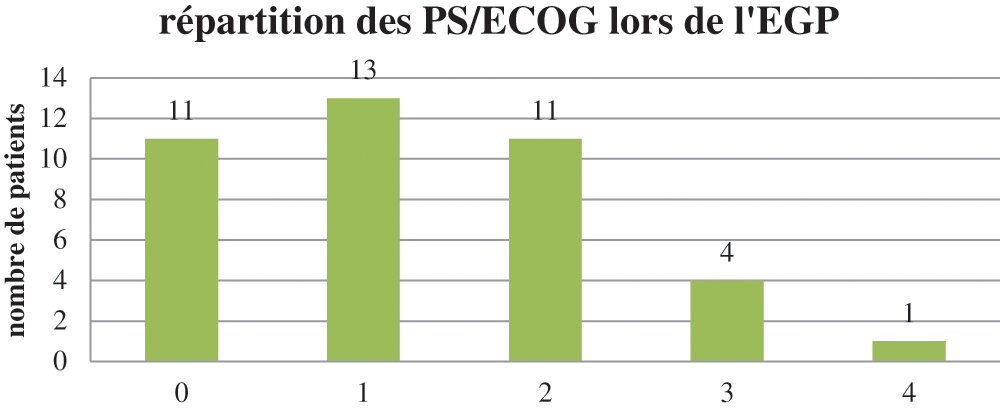
Figure 2: Distribution du Performans Status/ECOG des patients lors de l’EGP
27% des patients présentaient des troubles cognitifs (10 patients troubles légers MMS (Mini-mental State) ≥ 20, 1 patient avec des troubles modérés 10 ≤ MMS ≤ 20 et 1 patient avec des troubles sévères MMS < 10). Les investigateurs ont évalué que chaque patient était accessible à la compréhension de la lettre d’information et avait la capacité de pouvoir s’opposer à participer à cette étude.
Aucun des patients n’était sous curatelle ou tutelle, 48% des patients vivaient seul chez eux, 42% chez eux accompagnés, 8% en EHPAD (Etablissement d’Hébergement pour Personnes Agées Dépendantes) et 2% à l’hôpital.
32% des patients présentaient un cancer d’origine gynécologique/sénologique, 26% digestive, 10% pneumologique, 10% ORL, 8% hématologique, 6% urologique, 4% endocrinologique, 2% dermatologique et 4% non renseignées (pour 2 patients, oubli de la part de l’investigateur de renseigner cette donnée).
Dans notre étude, au moment de l’inclusion, 40 patients (80%) avaient reçu deux injections vaccinales anti-COVID-19, 4 patients une seule injection et 6 patients aucune.
Parmi ces 6 patients, 3 avaient pris rendez-vous pour réaliser leur vaccination, un autre patient ne pouvait pas la réaliser car il présentait une asthénie trop importante en lien avec sa chimiothérapie en cours, et 2 autres étaient fortement réticents à se faire vacciner. Ces deux derniers patients ont laissé un commentaire libre : « je ne voyais aucun intérêt de me faire vacciner, mourir du COVID ou d’autres choses, il faut mourir, je laisse ça aux autres » et « je ne voyais aucun intérêt de me faire vacciner, ne souhaite pas d’injection de virus dans mon corps ». Il s’agit de deux patientes, vivant seule, et ayant respectivement 92 et 93 ans.
Les 44 patients (ayant une ou deux injections) ont reçu leurs vaccins entre le 15/01/2021 et le 31/08/2021. Le délai médian entre la dernière dose de vaccin et l’inclusion des patients était de 100 jours (0-209).
Un questionnaire patient n’a pas été complété donc les données suivantes porteront sur 43 patients.
A la question « Si vous avez été vacciné contre la COVID-19, aviez-vous une réticence/des à priori face à cette vaccination ? », 88% ont répondu « aucune réticence », 7% « un peu de réticence » et 5% une « réticence moyenne ». Parmi les 5 patients ayant un peu ou moyennement de réticence, 4 ont répondu qu’elle était liée à la peur des effets secondaires du vaccin et 1 patient à la peur de recevoir le vaccin produit par Astrazaneca.
La première injection concerne un vaccin produit par Pfizer dans 82% des cas, par Astrazeneca à 11% et par Moderna 7%.
Lors de cette première injection, 86% des patients ont déclaré avoir eu une « très bonne tolérance » à cette vaccination, et 14% une « tolérance moyenne » (1 patient avec le vaccin d’Astrazeneca et 5 patients avec le vaccin de Pfizer).
Les effets secondaires les plus fréquemment rencontrés ont été listés et chaque patient devait coter la gradation de leur intensité. Pour chaque effet secondaire, 4 cotations différentes pouvaient être renseignées: « pas du tout », « un peu », « moyennement » et « fortement ». (Fig. 3).
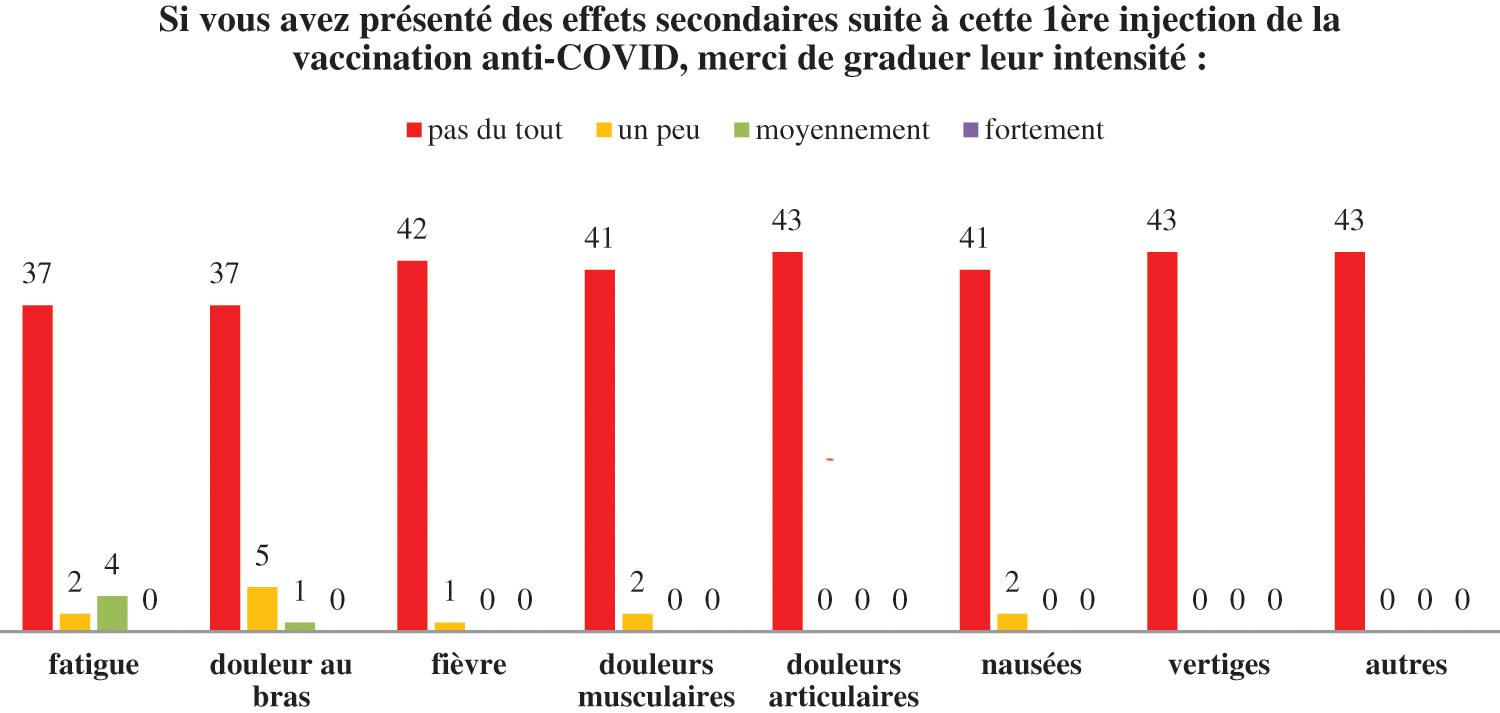
Figure 3: Gradation des effets secondaires les plus fréquemment rencontrés au cours de la 1ère injection du vaccin anti-COVID-19
Seulement quelques patients ont présenté une asthénie à la suite de la 1ère injection (2 patients « un peu » et 4 patients « moyennement »). 6 patients ont présenté une douleur au bras (5 patients « un peu » et 1 patient « moyennement »). 1 patient a présenté « un peu » de fièvre, 2 patients « un peu » de douleurs musculaires et 2 patients « un peu » de nausées.
Il n’y a pas eu d’hétérovaccination chez les patients ayant reçu deux injections, ils ont reçu le même type de vaccin à la première et à la seconde dose. Les intervalles entre les deux injections ont été respectés pour tous les patients en fonction du type de vaccin administré initialement.
A la 2ème injection, la tolérance a encore été meilleure qu’à la première, puisque 90% des patients ont déclaré avoir eu une « très bonne tolérance », 8% une « tolérance moyenne » (1 patient avec Moderna et 2 avec Pfizer) et 1 patient une « tolérance difficile » (avec Pfizer) (Fig. 4).
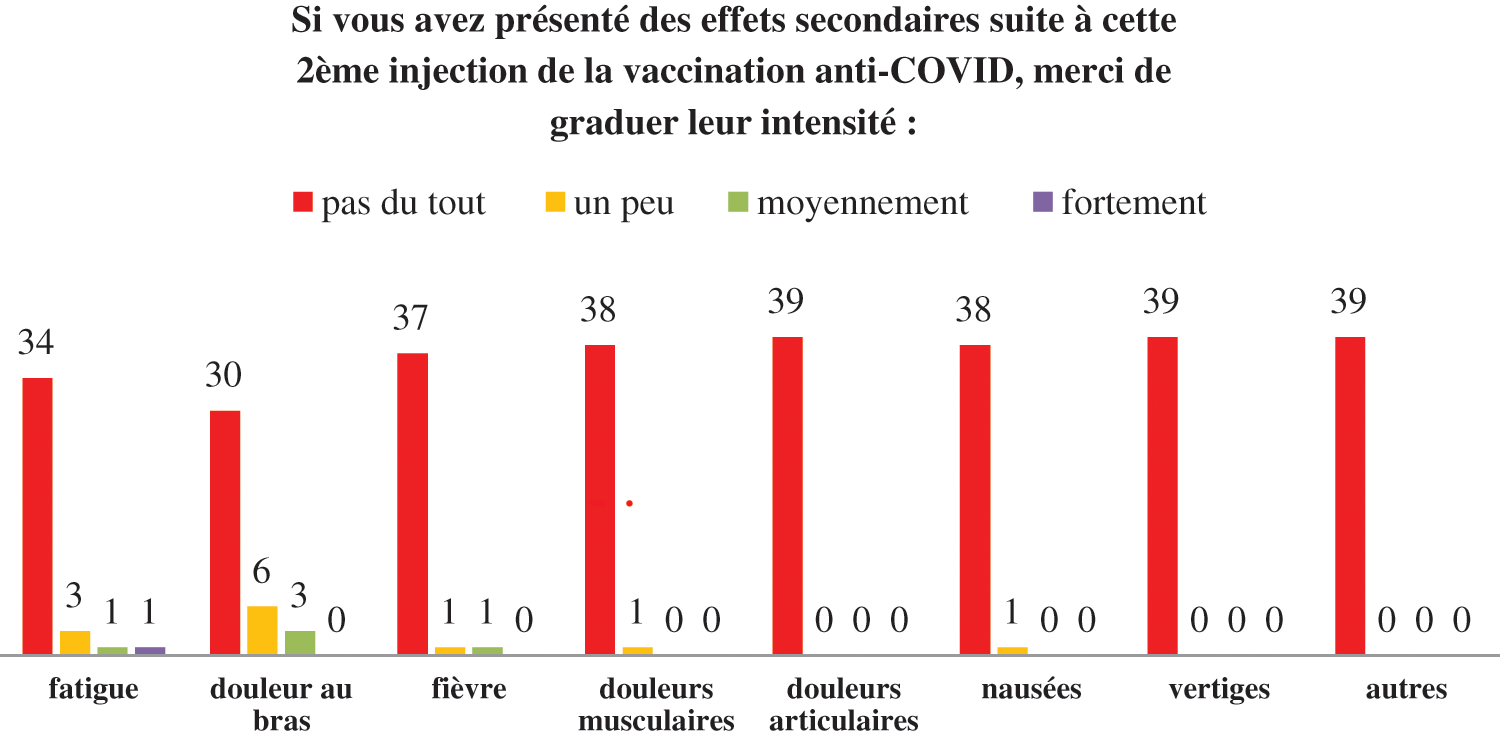
Figure 4: Gradation des effets secondaires les plus fréquemment rencontrés au cours de la 2ème injection du vaccin anti-COVID-19
Aucune différence statistique sur le profil de tolérance des patients par rapport au contexte de la demande de l’EGP (chimiothérapie intraveineuse/immunothérapie, chirurgie, pas de formulation particulière ….) ni par rapport à la nature de la tumeur primitive (les 4 patients ayant un cancer hématologique, potentiellement avec un risque d’aplasie, ont eu une « très bonne tolérance » aux deux injections).
15 patients (37%) ont déclaré n’avoir pas pris seul la décision de se faire vacciner. 6 patients ont déclaré avoir été influencé par leur entourage, 5 patients par leur médecin traitant, 3 patients par l’équipe médicale qui le suit, 1 par son pharmacien et 1 patient qui n’a pas précisé.
A la question « recommandez-vous à votre entourage de se faire vacciner ? » ; aucun patient a répondu « non », 25% « un peu », 73% « complètement », 1 patient « chacun fait son choix », et 3 patients n’ont pas répondu.
Dans la cadre de notre étude, nous avons souhaité faire un point sur la couverture vaccinale des autres vaccins. Concernant le vaccin de la grippe saisonnière, 73% des patients l’avaient reçu au cours des derniers mois. 43% étaient à jour pour leur vaccin contre le DT Polio (Diphtérie, Tétanos), 39% pour lesquels les gériatres n’ont pas su répondre à la question. Pour le vaccin contre le Pneumocoque, seulement 10% étaient à jour et pour 50% des patients, les gériatres n’ont pas su répondre.
Dans le cadre de notre étude seulement 12% des patients âgés de 70 ans et plus porteurs de cancer n’étaient pas vaccinés. Très peu de patients ont déclaré avoir de réticence face à cette vaccination. Cependant, il est important de noter que la campagne vaccinale concernant ces patients a commencé le 21 janvier 2021, notre étude recouvrant la période du 01 mai au 31 aout 2021 il aurait été logique par conséquent, en fonction du profil patient, de retrouver une couverture vaccinale quasi-totale pour la population de notre étude.
L’entourage du patient et le personnel soignant ont une place prépondérante pour encourager les sujets âgés à adhérer à cette vaccination. Parmi les 15 patients ayant répondu n’avoir pas pris seul la décision de se faire vacciner, les deux patients de l’étude vivant en EHPAD en faisaient partie ce qui met en évidence le rôle du personnel soignant dans la sensibilisation à la vaccination.
Par conséquent, comme il l’a été souligné oralement par certains patients au cours de l’EGP, il est hautement probable que la logistique concernant l’accès à la vaccination a été de nature à complexifier le parcours vaccinal de ce profil patient. En effet nous comptons plusieurs écueils :
– la nécessité d’avoir une connexion et une capacité de compréhension du fonctionnement de la prise de rendez-vous sur la plate-forme
– l’accessibilité des rendez-vous vite saturée
– la difficulté pour se rendre au centre de vaccination suivant l’intégrité ou pas de son autonomie physique
– la disponibilité des médecins traitants/spécialistes et autres professionnels de santé pour prendre les rendez-vous pour la personne âgée dans les centres de vaccination à l’extérieur de l’établissement de santé (ETS) ou dans les ETS (filière de vaccination organisée pour les patients suivis dans l’ETS)
– la capacité cognitive, disponibilité ou équipement de l’aidant pour prendre le rendez-vous
S’ajoute à ces différents points la notion de fatalité d’acceptation de la mort qui s’observe chez certains patients et qui impacte la motivation de la personne âgée à se faire vacciner de la COVID-19 (cf verbatim).
Ces différents constats nous amènent à penser qu’afin de faciliter l’accessibilité à ces nouveaux outils, il aurait été pertinent d’y introduire à un lien intermédiaire humain entre la plate-forme et le sujet âgé (ex : mise à disposition d’e-bus, service dans les mairies…).
La tolérance à la vaccination des sujets âgés porteurs de cancer de notre étude a été très bonne. 86% des patients en 1ère injection et 90% en 2ème injection ont déclaré une très bonne tolérance, des chiffres de tolérance bien meilleure que pour la population générale [9]. L’immunosénescence explique en partie la plus grande vulnérabilité des personnes âgées à l’infection à la COVID-19 mais également cette bonne tolérance à cette vaccination. Ainsi, il est important, afin de protéger cette population âgée en obtenant une immunité collective. Inciter son entourage à se faire vacciner participe de renforcer cette immunité collective et permet de diminuer le risque d’apparition de nouveaux variants. Il a noté que le score médian oncodage G8 de notre population étant de 13 et le Performans status/ECOG de 1, 3, notre population présentant un état général relativement correct ce qui laisse supposer une meilleure tolérance à la vaccination anti-COVID-19.
Notre étude portant uniquement sur les sujets âgés, il est à noter qu’il peut y avoir un biais dans le remplissage des formulaires des patients par rapport au fait qu’ils puissent potentiellement avoir des troubles de la mémoire et que le délai médian était de 100 jours entre la dernière dose vaccinale reçue et le remplissage des questionnaires.
La mise à jour de la vaccination par les professionnels de santé demande une attention de tous les acteurs de soin notamment pour des vaccins contre le DT Polio et la Pneumocoque qui ont des schémas vaccinaux particuliers en terme de fréquence vaccinale, double injection… Il est important de sensibiliser les médecins généralistes, les oncologues, les pharmaciens… à cette prise en charge, notamment en leur rappelant les recommandations vaccinales faites par la Haute Autorité de Santé, le Haut Conseil de Santé Public et l’Institut National de Prévention et d’Education de Santé [10–12]. Il est indispensable de connaitre ce qui est réalisable en cours de traitement de chimiothérapie/immunothérapie et la marche à suivre en fin de traitement anticancéreux pour mettre à jour cette couverture vaccinale [13]. En 2018, selon les chiffres de la Caisse Primaire d’Assurance Maladie, pour les patients porteurs de cancer en Bretagne, 47%, 7% avaient reçu le vaccin de la grippe saisonnière tout âge confondu et 68%, 8% des 75 ans et plus (22%, 0% pour le DT Polio tout âge confondu et 20%, 8% pour les 75 ans et plus et pour le pneumocoque, 18.0% tout âge confondu vs. 15%, 2% pour les 75ans et plus). La couverture vaccinale peut-être optimisée par une sensibilisation à la fois des patients et des professionnels de santé [13].
Globalement, dans notre étude, les patients âgés porteurs de cancer ne présentaient pas de réticence à la vaccination anti-COVID-19 et ont eu une très bonne tolérance à ces vaccins. Cependant, au vu du profil de ces patients et de la période d’inclusion, le nombre de patients présentant un schéma vaccinal complet aurait pu être plus conséquent. Depuis plusieurs années, l’UCOG Bretagne contribue à promouvoir l’approche oncogériatrique en optimisant les connaissances, la diffusion des bonnes pratiques et la prise en soins de la personne âgée atteinte de cancer (mise en place d’études, participation à des groupes de travail, de publications….) Au cours de cette pandémie, notre structure a élaboré des outils de communication de sensibilisation à la vaccination anti-COVID-19 en collaboration avec l’ARS Bretagne (Agence Régionale de Santé) et les différents partenaires régionaux (Pole régional de Cancérologie, Observatoire du Médicament des Dispositifs Médicaux et des Innovations Thérapeutiques, réseau OncoBretagne, Caisse Primaire d’Assurance Maladie, Ligue contre le Cancer…) [14].
Author Contributions: Participation à la rédaction du protocole/méthodologie : Delphine Déniel, Fabienne Le Goc-le Sager, Laurence Guen, Christophe Perrin, Sandrine Estivin.Participation aux inclusions et recueil de données : Paul touchard, Véronique Marty, Laurence Hasle, Véronqiue Jestin Le Tallec, Monique Jegaden, Annaïk Pestel, Virginie Jannou, Sophie Pentecôte, Sandrine Estivin. Réalisation des statistiques/résultats : Delphine Déniel, Laurence Guen. Rédaction de l’article : Delphine Déniel, Fabienne Le Goc Le Sager, Christophe Perrin, Sandrine Estivin. Relecture/correction de l’article : Paul touchard, Véronique Marty, Laurence Hasle, Véronqiue Jestin Le Tallec, Monique Jegaden, Annaïk Pestel, Virginie Jannou, Sophie Pentecôte.
Ethics Approval and Informed Consent Statement: L’UCOG Bretagne a complété une dérogation à une conformité de la méthodologie de référence à la CNIL MR03 (numéro de déclaration 2016060 v 0). L’étude a été soumise au comité d’éthique du CHU de Rennes. Un avis favorable a été émis le 19 avril 2021 ( n°21.36). Une lettre d’information a été propose à chacun des patients participants à cette étude et une non-opposition a été attestée par l’investigateur.
Acknowledgement: Nous tenons à remercier les infirmières de coordination de l’UCOG Bretagne pour leur contribution à la participation de cette étude (Mme Armelle Henri, Mme Nelly Chanoni et Mme Anne Lorre). Un remerciement tout particulier également à l’équipe mobile du CH Lannion, Mme Le Parquer, pour leur précieuse collaboration.
Funding Statement: The authors received no specific funding for this study.
Conflicts of Interest: The authors declare that they have no conflicts of interest to report regarding the present study.
Références
1. Pinato, D. J., Lee, A. J. X., Biello, F., Seguí, E., Aguilar-Company, J. et al. (2020). Presenting features and early mortality from SARS-CoV-2 infection in cancer patients during the initial stage of the COVID-19 pandemic in Europe. Cancers, 12(7), 1841. DOI 10.3390/cancers12071841. [Google Scholar] [CrossRef]
2. Williamson, E. J., Walker, A. J., Bhaskaran, K., Bacon, S., Bates, C. et al. (2020). Factors associated with COVID-19-related death using OpenSAFELY. Nature, 584, 430–436. DOI 10.1038/s41586-020-2521-4. [Google Scholar] [CrossRef]
3. INCa (2021). Préconisations de priorisation des patients atteints de cancer pour la vaccination contre le SARS-CoV-2. Définition des patients ultra-prioritaires. [Google Scholar]
4. https://www.santepubliquefrance.fr/determinants-de-sante/vaccination/donnees. [Google Scholar]
5. https://solidarites-sante.gouv.fr/ministere/documentation-et-publications-officielles/rapports/suivi-de-la-crise-sanitaire/article/note-drees-repartition-des-entrees-hospitalieres-selon-le-statut-vaccinal. [Google Scholar]
6. Alleaume, C., Verger, P., Dib, F., Ward, J. K., Launay, O. et al. (2021). Intention to get vaccinated against COVID-19 the genral population in France : Associated factors and gender disparities. Human Vaccines & Immunotherapeutics, 17(10), 3421–3432. DOI 10.1080/21645515.2021.1893069. [Google Scholar] [CrossRef]
7. https://www.omeditbretagne.fr/cancer/vaccination-et-cancer/. [Google Scholar]
8. https//www.gouvernement.fr/info-cronavirus/carte-et-donnee.fr. [Google Scholar]
9. Zhu, F. C., Li, Y. H., Guan, X. H., Hou, L. H., Wang, W. J. et al. (2020). Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: A dose-escalation, open-label, non-randomised, first-in-human trial. Lancet, 395(10240), 1845–1854. DOI 10.1016/S0140-6736(20)31208-3. [Google Scholar] [CrossRef]
10. HAS: Haute Autorité de Santé–rapport(2012). « Vaccinations des personnes immunodéprimées ou aspléniques ». [Google Scholar]
11. HCSP: Haut Conseil de Santé Publique–avis et rapports de(2013). [Google Scholar]
12. INPES: Institut National de Prévention et d’Education pour la Santé « Vaccinations chez les adultes immunodéprimés » (2015). [Google Scholar]
13. Fronteau, H., Le Tallec, V. J., Loisel, I., Estivin, S., Corre, R. et al. (2018). L’état vaccinal des sujets âgés atteints de cancer recevant une chimiothérapie : Rappel des recommandations et zoom sur la région bretagne. Oncologie, 20, 129–136. DOI 10.3166/onco-2018-0018. [Google Scholar] [CrossRef]
14. Lagadec, D. D., Guen, L., Le Sager, F., Estivin, S., Perrin, C. (2021). Feedback from professionals on the care of cancer patients during the COVID-19 epidemic in the Brittany region. Retour d’expérience des professionnels sur la prise en charge des patients en cancérologie pendant l’épidémie de la COVID-19 dans la région Bretagne. Oncologie, 23(1), 39–46. DOI 10.32604/Oncologie.2021.015985. [Google Scholar] [CrossRef]
The Annexe 1 is attached as the Supplementary Document.
 | This work is licensed under a Creative Commons Attribution 4.0 International License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. |