
 | Oncologie |  |
DOI: 10.32604/Oncologie.2021.15525
REVIEW
Fondamentaux de l’immunologie des Cancers Digestifs (Gastriques et Hépatocellulaires)
1HIA Brest, Rue Colonel Fonferrier, Gastroentérologie, Brest, 29200, France
2CHU Morvan, 2 av Foch, Oncologie Digestive, Brest, 29200, France
*Corresponding Author: Pierre-Guillaume Poureau. Email: pierre-guillaume.poureau@chu-brest.fr
Received: 25 December 2020; Accepted: 24 February 2021
Abstract: L’immunothérapie des cancers digestifs est en plein essor et pour la première fois un inhibiteur de point de contrôle immunitaire a obtenu une autorisation de mise sur le marché pour le traitement d’un cancer digestif. Afin d’appréhender au mieux le mécanisme d’action de ces traitements, leurs effets secondaires et l’échappement à ces traitement, il est nécessaire de connaître les fondamentaux de l’immunologie des cancers. Le système immunitaire inné et adaptatif permet l’élimination des cellules cancéreuses par cytotoxicité directe non spécifique (cellules Natural Killer), par le développement d’une réponse adaptative à médiation cellulaire (cellules dendritiques devenant cellules présentatrices d’antigène, permettant la différenciation des lymphocytes naïfs en lymphocytes T CD4 et CD8) et par immunité humorale (par l’intermédiaire des lymphocytes B). Un état d’équilibre peut s’établir. Un des processus d’oncogenèse est ensuite l’échappement des cellules tumorales au contrôle immunitaire, par la perte de leur capacité de présentation antigénique, par le recrutement de cellules immunosuppressives ou par l’expression à leur surface de molécules de costimulation inhibitrice (PD-L1, Galectine 9) interagissant avec leur ligand sur le lymphocyte (PD-1, Tim-3) et aboutissant à une inactivation de la réponse immunitaire. Ces protéines correspondent aux points de contrôle immunitaire et sont la cible des principales molécules d’immunothérapie actuellement utilisées. Il est ensuite fait un panorama des connaissances sur la valeur pronostique du micro environnement tumoral des cancers gastriques et des hépatocarcinomes.
Immunotherapy for digestive cancers is booming and for the first time an immune checkpoint inhibitor has been granted marketing authorization for the treatment of digestive cancer. In order to better understand the mecanism of action of these treatments, their adverse events and the escape mecansim, it is necessary to know the fundamentals of cancer immunology. The innate and adaptive immune system allows the elimination of cancer cells by direct non-specific cytotoxicity (Natural Killer cells), by the development of an adaptive cell-mediated response (dendritic cells becoming antigen presenting cells, allowing the differentiation of lymphocytes naive in CD4 and CD8 T lymphocytes) and by humoral immunity (via B lymphocytes). A state of equilibrium can be established. One of the oncogenesis processes is then the escape of tumor cells from immune control, by the loss of their antigen presentation capacity, by the recruitment of immunosuppressive cells or by the expression on their surface of inhibitory costimulatory molecules (PD-L1, Galectin 9) interacting with their ligand on the lymphocyte (PD-1, Tim-3) and resulting in inactivation of the immune response. These proteins correspond to immune checkpoints and are the target of major immunotherapy molecules currently in use. A panorama of knowledge on the prognostic value of the tumor microenvironment of gastric cancers and hepatocarcinomas is then made.
Keywords: Inhibiteur de point de contrôle; immunologie des cancers; oncogenèse; échappement; valeur pronostique du micro environnement immunitaire; cancer gastrique; carcinome hépatocellulaire
Keywords: Checkpoint inhibitor; cancer immunology; oncogenesis; escape; pronotic value of the tumor microenvironment; gastric cancer; hepatocarcinoma
L’immunothérapie s’accélère dans les cancers digestifs avec plusieurs présentations très prometteuses aux derniers congrès internationaux, qui vont modifier en profondeur nos pratiques. En effet, l’essai MK590 a montré la supériorité du pembrolizumab en association à la chimiothérapie dans le traitement des cancers œsogastriques avancés en première ligne par rapport à la chimiothérapie seule [1]. L’an dernier il s’agissait de l’essai MK181 évaluant le nivolumab en deuxième ligne, positif pour les carcinomes épidermoïdes ou tous cancers avec CPS > 10 [2]. Et depuis peu, un anticorps anti PD-L1 est disponible en prescription hors essai pour la première fois dans le digestif avec l’ATU de l’atezolizumab en association au bevacizumab dans le traitement du carcinome hépatocellulaire avancé, suite à la positivité de l’essai IMbrave 150 [3].
La gestion des toxicités des immunothérapies est désormais bien décrite et connue. Mais ces traitements sont bénéfiques à une certaine proportion de patients seulement, que l’on ne parvient pas toujours à identifier. La compréhension des mécanismes fondamentaux d’immunologie des cancers permettra de mieux appréhender ces molécules, d’identifier des biomarqueurs prédictifs éventuels, de connaitre les mécanismes d’échappement au traitement et d’identifier ainsi de nouvelles cibles thérapeutiques potentielles.
2 Immunologie du cancer [4]
Les processus d’oncogenèse se caractérisent par l’indépendance vis-à-vis des facteurs de croissance, la résistance aux inhibiteurs de la prolifération, la résistance à la mort cellulaire, l’immortalisation, la capacité à promouvoir l’angiogenèse et la capacité à envahir les tissus et traverser les membranes basales [5]. Un autre mécanisme plus récemment admis est l’échappement au système immunitaire. Le développement d’une tumeur dépend de l’équilibre entre une réponse immunitaire anti tumorale capable d’éliminer les cellules cancéreuses et les mécanismes d’échappement au système immunitaire. Ce phénomène de réponse immunitaire anti tumorale est appelé « immunosurveillance antitumorale ». Elle découle de l’observation de la régression de sarcomes osseux corrélés à la survenue de surinfection postopératoire par un streptocoque pathogène par William B.Cooley. Des travaux ont ensuite prouvé ce concept avec des souris déficientes en certains composants du système immunitaire. En effet, des souris déficientes pour les gènes RAG (Recombination activating Gene) sont déficientes en lymphocytes B et T matures, et présentent une fréquence accrue de tumeurs spontanées ou induites par comparaison à des souris sauvages.
Aujourd’hui, c’est la théorie de Robert Schreiber, théorie de l’immunoédition [6], ou théorie des 3 E (Elimination, Equilibre, Echappement), qui est communément admise. Cette théorie est basée sur le fait que l’interaction entre le système immunitaire et la cellule tumorale peut conduire à l’élimination de la tumeur, à un état d’équilibre (avec une maitrise de la prolifération tumorale sans élimination), ou à un échappement de la cellule tumorale au contrôle immunologique, laissant alors penser que le système immunitaire est devenu inefficace pour contrôler la croissance tumorale.
Les cellules tumorales sont reconnues et éliminées par le système immunitaire. Cette réponse immunitaire à la cellule tumorale résulte de l’activation de deux systèmes de défense: le système d’immunité innée et le système d’immunité adaptatif impliquant des réponses humorales (lymphocytes B) et des réponses à médiation cellulaire (lymphocytes T) (Fig. 1).
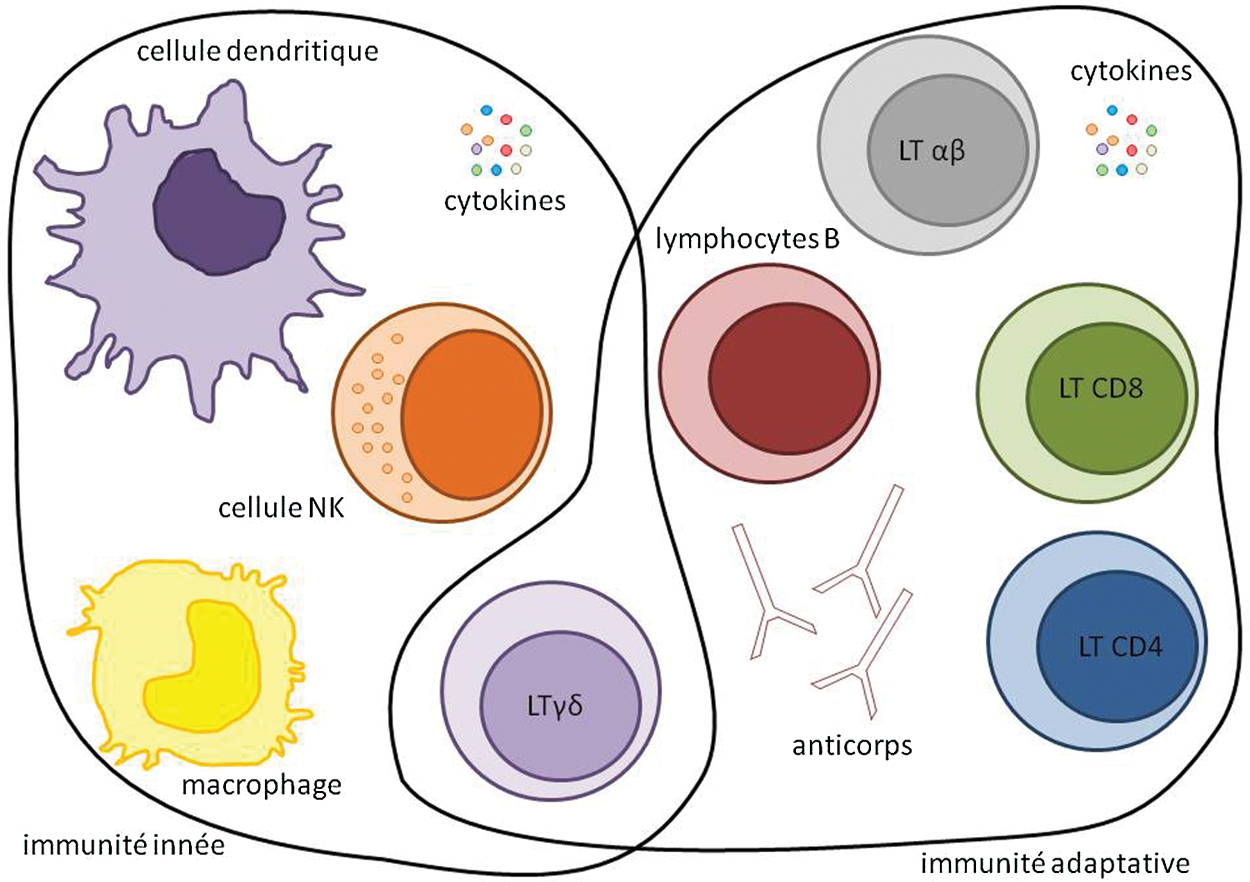
Figure 1: Les acteurs de l’immunité innée et adaptative
2.1.1 L’immunité innée [4]
La réponse immunitaire innée est la première réponse de l’organisme à une agression. Elle joue un rôle majeur dans la mise en place des réponses immunitaires adaptatives et des processus de réparation tissulaire. Contrairement à l’immunité adaptative, la réponse innée n’est pas spécifique d’un antigène et n’est pas douée de mémoire. La majorité des cellules de l’immunité innée sont d’origine myéloïde; il s’agit des polynucléaires (ou granulocytes) et des phagocytes mononuclées (monocytes, macrophages et cellules dendritiques). Il existe également des cellules d’origine lymphoïde comme les cellules Natural Killer (NK), et des cellules lymphoïdes non conventionnelles comme les lymphocytes Tγδ, les cellules NK-T, les cellules lymphoïdes innées (Innate Lymhpoïd Cells: ILC) et les MAIT (Mucosal-Associated Invariant T cells). L’immunité innée repose également sur des médiateurs solubles, participant à l’initiation et à la régulation de la réponse inflammatoire et de l’immunité innée. Ceux-ci comprennent principalement le système du complément et les cytokines.
L’immunité du cancer fait agir principalement les cellules NK. Les lymphocytes Tγδ sont très proches des cellules NK mais expriment un TCR reconnaissant des ligands variés différents du CMH. Les cellules NK-T, les MAIT et les ILC ont surtout un rôle dans la reconnaissance d’agents microbiens et dans la défense contre les micro-organismes. Enfin, les cellules dendritiques vont faire le lien entre l’immunité innée et l’immunité adaptative.
Les lymphocytes Natural Killer (NK) ont la capacité de lyser des cellules infectées ou tumorale en l’absence d’immunisation spécifique préalable, ce qui les différencie des lymphocytes T CD8. Leur activité cytotoxique s’exerce par plusieurs mécanismes similaires à ceux employés par les LT CD8: dégranulation (perforine, granzyme B), déclenchement d’apoptose par interaction de molécules membranaires (Fas, TRAIL…), sécrétion de TNFα, production de cytokines comme l’IFNγ. La lyse cellulaire est déclenchée en fonction de la résultante de la stimulation de récepteurs activateurs ou inhibiteurs. Les cellules NK reconnaissent le CMH de classe I présent sur la plupart des cellules du soi saines, ce qui inhibe leur fonction. La perte d’expression du CMH-I conduit donc à l’activation des fonctions effectrices NK. Les récepteurs activateurs sont nombreux. Parmi les plus importants, on note le CD16, qui est un récepteur pour le fragment constant des IgG. Il est responsable du phénomène de cytotoxicité dépendante des anticorps (ADCC: Antibody-Dépendant Cellular Cytotoxicity), grâce auquel les cellules NK détectent et détruisent les cellules opsonisées c'est-à-dire recouverte d’anticorps. Les autres récepteurs activateurs reconnaissent des ligands exprimés par des cellules dites « stressées » (avec altération de leur ADN par exemple). On note principalement les récepteurs de la famille NCR et les récepteurs CD94/NKG2D.
Les cellules dendritiques sont dérivées d’un progéniteur myéloïde. Les cellules dendritiques sont très nombreuses dans les tissus en contact avec le milieu extérieur et forment un réseau de cellules sentinelles, elles sont à l’état immature. Dans cet état, elles disposent d’une grande faculté à reconnaître et capturer les antigènes (de pathogènes ou de cellules tumorales), par phagocytose, endocytose ou pinocytose. Une fois l’antigène capturé, plusieurs évènements aboutissent à la maturation des cellules dendritiques. L’activation de cellules effectrices de l’immunité innée, les interactions cellulaires et le micro environnement cytokinique font entrer les cellules dendritiques dans ce programme de maturation, leur faisant perdre l’expression de récepteurs spécifiques de l’endocytose et de la phagocytose, et deviennent dévolues à la présentation de l’antigène. Elles expriment à leur surface une grande quantité de molécules du CMH. La maturation des cellules dendritiques leur permet une migration de la périphérie vers les ganglions lymphatiques de drainage, notamment par l’expression de CCR7.
Dans le ganglion, la réponse lymphocytaire va être déclenchée par les cellules dendritiques matures, devenues cellules présentatrice d’antigène (CPA). L’activation complète aboutissant à l’expansion clonale des lymphocytes T nécessite une interaction prolongée entre la cellule dendritique mature et le lymphocyte T. Ce dialogue fait intervenir la reconnaissance de l’antigène par le TCR (récepteur T) associé au complexe CD3, les molécules du CMH, les molécules de costimulation et les molécules d’adhésion. Cette communication est appelée synapse immunologique (Fig. 2).
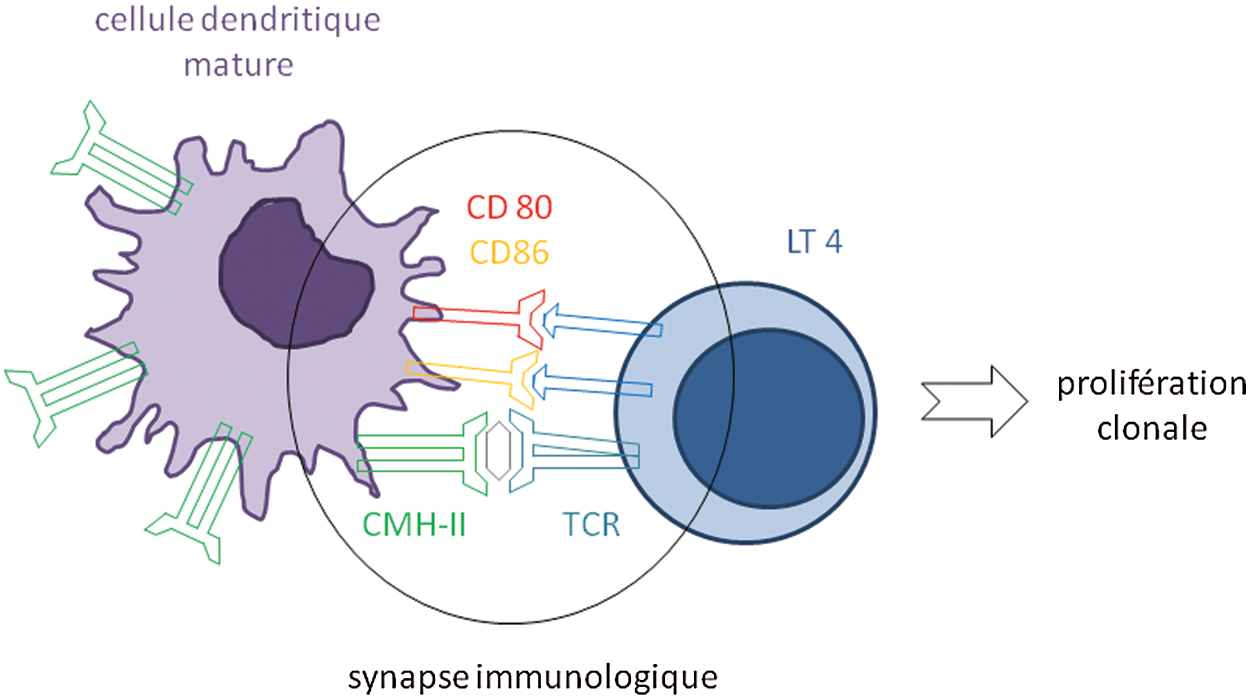
Figure 2: Mise en place de la synapse immunologique dans le ganglion lymphatique
2.1.2 L’immunité adaptative [4]
Différenciation des lymphocytes T
Les lymphocytes T naïfs reconnaissent, par leur récepteur TCR, les antigènes présentés par les CPA associés au complexe majeur d’histocompatibilité (CMH) de classe 2. L’interaction TCR/complexe peptide-CMH doit être prolongée et de forte intensité pour être efficace dans l’activation du lymphocyte T naïf. Ce premier signal d’activation seul n’est pas suffisant pour déclencher la prolifération et la différenciation du lymphocyte T; l’activation de molécules de costimulation est nécessaire. Les Lymphocytes T expriment à leur surface la molécule de costimulation activatrice CD28, qui se lie aux molécules CD80 et CD86 présentes à la membrane de la CPA. Ceci permet la sécrétion d’IL-2 nécessaire à la prolifération lymphocytaire T, et induit aussi l’expression de CD40-Ligand à la surface du lymphocyte T. La liaison à CD40, exprimé par les cellules dendritiques, induit une augmentation de CD80/CD86, qui à son tour renforce le signal induit par CD28. Une boucle positive d’activation s’établit et induit une forte prolifération des lymphocytes T spécifiques de l’antigène initialement reconnu. Un troisième signal d’activation va être donné par les cytokines présentes dans le micro environnement des ganglions lymphatiques, majoritairement produites par les cellules dendritiques. Ces cytokines vont participer à la différenciation des lymphocytes T CD4 naïfs, en lymphocytes T auxiliaires (T helper ou Th) ou en lymphocytes T à activité régulatrice T reg (Fig. 3).
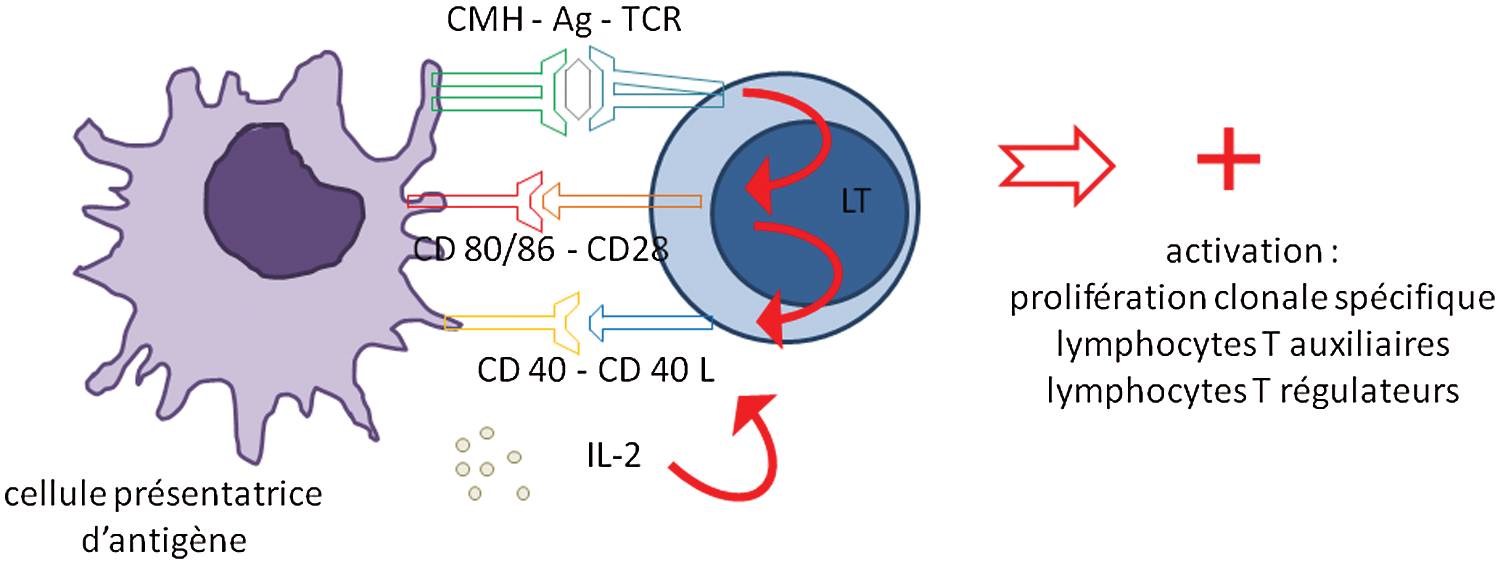
Figure 3: Molécules participant à l’activation du lymphocyte T
Les lymphocytes T CD4 activés vont alors sécréter des cytokines dont l’interféron γ (IFNγ), le TNFα et l’interleukine 2 (IL-2) par les lymphocytes de type Th1 (lymphocyte T auxiliaire ou helper). L’IFNγ a une activité anti cancéreuse majeure en inhibant l’angiogenèse, en induisant la sénescence des cellules tumorales, et en activant les fonctions tueuses des cellules de l’immunité innée ou adaptative. Les lymphocytes Th2 vont sécréter majoritairement de l’IL-4, IL-5 et IL-13. Le développement des sous populations lymphocytaires Th1 et Th2 est mutuellement antagoniste. Les lymphocytes Th17 secrètent principalement de l’IL-22. Ces cellules sont surtout importantes pour le contrôle des infections bactériennes extra cellulaires et fongiques et sont impliquées dans des maladies auto-immunes et inflammatoires.
Pour empêcher une prolifération incontrôlée, un rétrocontrôle est nécessaire. Pour cela, le signal TCR/CD28 induit également, mais plus tardivement, l’expression de la molécule CTLA-4 (Cytotoxic T Lymphocyt Antigen) qui se lie à CD80/CD86 avec une plus forte affinité que CD28 et ne transmet pas de signal activateur. Il en résulte un signal d’inhibition de la boucle d’activation décrite plus haut. En plus de CTLA-4, d’autres molécules inhibitrices interviennent plus tardivement dans les interactions lymphocytes T/cellules dendritiques, dits points de contrôle immunitaires (PCI) (check point). Par exemple, TIM-3 et PD-1. Le PD-1 est reconnu par 2 ligands, PD-L1 et PD-L2. La régulation négative par PD-1 entraine une diminution des fonctions effectrices lymphocytaire c'est-à-dire une diminution de la libération des cytokines et une diminution de la cytotoxicité (Fig. 4). Cependant, cette régulation négative peut limiter l’efficacité protectrice du système immunitaire en situation d’exposition antigénique chronique où l’augmentation des signaux inhibiteur conduit à l’épuisement et à l’échappement des réponses lymphocytaires T. Les lymphocytes T spécifiques d’antigènes qui ne sont pas éliminés sont appelés lymphocytes T mémoires.
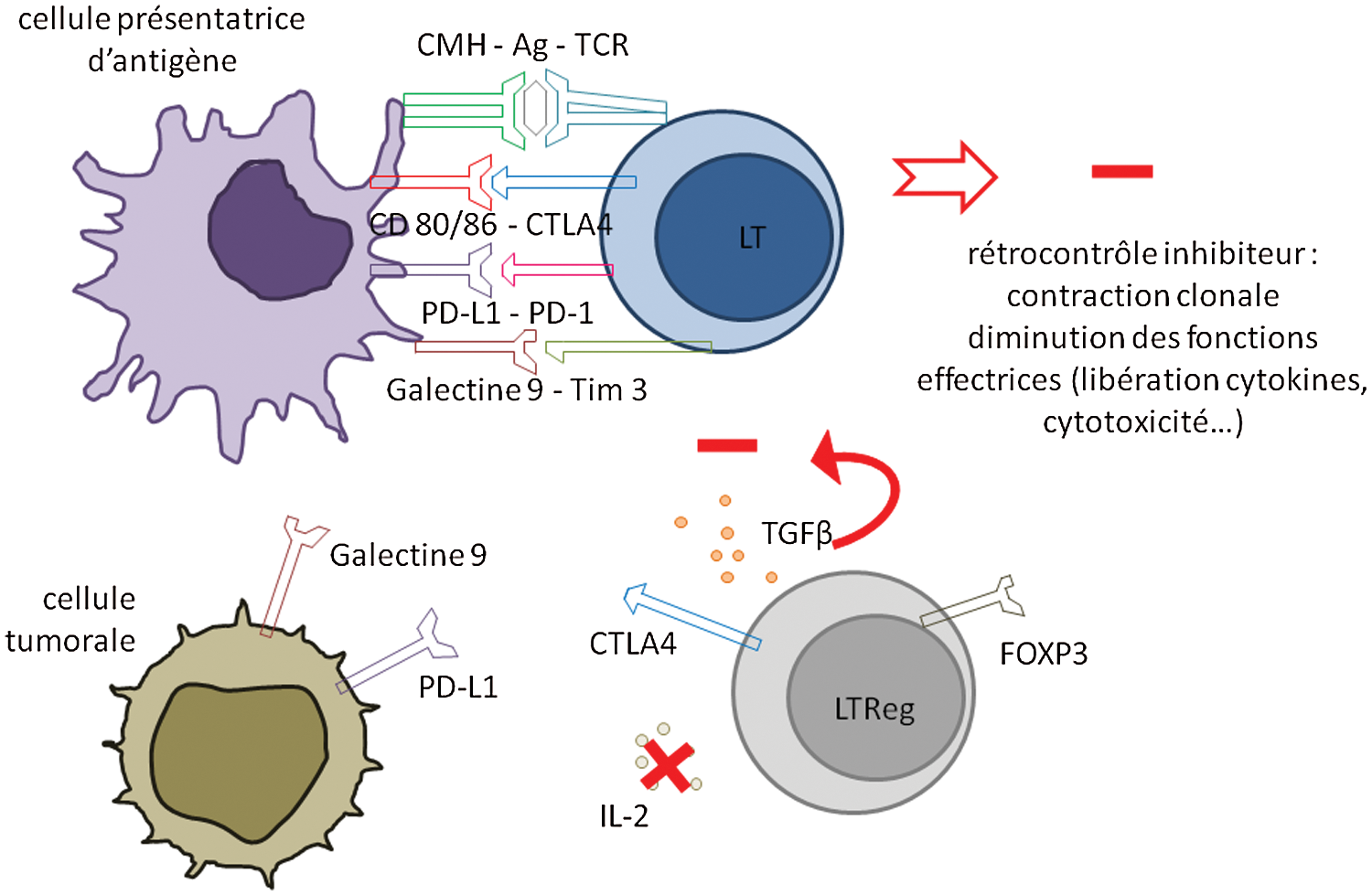
Figure 4: Rétrocontrôle inhibiteur aboutissant à l’échappement immunitaire
Les lymphocytes T régulateurs (LTreg) participent au rétrocontrôle inhibiteur. Les LTreg naturels expriment FoxP3. Les LTreg périphériques ou adaptatifs se développent à partir des LT CD4 naïfs dans un environnement propice à leur maturation. Ils vont alors exprimer FoxP3, ce qui leur confère une action suppressive, notamment par l’expression de CTLA-4, par production de TGFβ (cytokine immunosuppressive), et par absorption d’IL-2 environnante.
Les lymphocytes T CD8 naïfs vont être activés après la reconnaissance de l’antigène tumoral via le CMH de classe 1 à la surface de la cellule tumorale pour devenir des lymphocytes T CD8 cytotoxiques. L’activation est déclenchée par la reconnaissance via leur TCR du complexe antigène/CMH de classe I présenté par les CPA. L’activation nécessite un second signal de costimulation B7 (CD80/CD86-CD28). Elle nécessite un troisième signal cytokinique, en particulier IL-2 et IFNγ sécrété par les Th1. Les lymphocytes T CD8 activés vont produire de l’IL-2 participant à leur propre expansion clonale.
Une fois activé, les LT cytotoxiques reconnaissent les cellules exprimant l’antigène associé au CMH de classe I. Ceci va activer leur fonction cytotoxique, par la libération de granules préformés contenant de nombreuses enzymes et cytokines dont la perforine et les granzymes; mais aussi par l’interaction de molécules membranaires exprimées à la surface du LT cytotoxique (Fas, TNF membranaire, TNF soluble) induisant via le récepteur de la cellule cible (tumorale ou infectée) une apoptose. Le lymphocyte T cytotoxique peut ensuite rechercher d’autres cibles avant de rentrer lui même en apoptose
La contraction clonale des lymphocytes T CD8 est à la fois passive par l’apoptose des lymphocytes T CD8 et par la diminution des signaux activateurs du fait de l’élimination de l’antigène; et active (mort induite par activation) du fait de l’activation antigénique prolongée faisant intervenir les molécules CTLA-4 et PD-1.
La réponse humorale [4]
La réponse immunitaire humorale repose sur la sécrétion d’immunoglobulines par les plasmocytes, dérivés des lymphocytes B. Le rôle de la réponse humorale naturelle contre les tumeurs n’est pas clairement établi. Toutefois, lorsqu’un anticorps est fixé sur sa cible tumorale, il peut entrainer une lyse de la cellule par un mécanisme de toxicité cellulaire dépendante de l’anticorps appelé ADCC (Antibody-Dependant Cellular Cytotoxicity).
Les lymphocytes B naïfs ou immatures sortent de la moelle osseuse et circulent dans les organes lymphoïdes secondaires. Après activation par un antigène spécifique, ils peuvent soit se différencier en plasmocytes à IgM à courte durée de vie, soit former des centres germinatifs où ils se différencient en plasmocytes à longue durée de vie ou lymphocytes B mémoire. Dans le ganglion lymphatique, le lymphocyte B naïf va rencontrer l’antigène pour lequel il est spécifique via le récepteur BCR. Ceci va induire l’expression de CCR7 qui va favoriser sa migration à l’interface des zones B et T. Le lymphocyte B va alors interagir avec le lymphocyte T activé par le même antigène. Le Lymphocyte B va exprimer les molécules CD80/CD86, qui se lient au CD28 présent sur le lymphocyte T. Ce signal de costimulation induit l’expression de CD40 ligand qui se lie au CD40 présent sur le lymphocyte B, ce qui lui délivre à son tour un signal de costimulation, indispensable à la prolifération des lymphocytes B et à la formation des centres germinatifs. D’autres interactions membranaires sont impliquées dans la coopération B-T comme l’interaction ICOS/ICOS ligand et les protéines de la famille SLAM. Le lymphocyte reçoit également des signaux solubles nécessaires à sa prolifération comme l’IL-4 et à sa maturation comme l’IL-21 conduisant à la différenciation en plasmocytes. Les lymphocytes B activés vont former des centres germinatifs dans lequel ils prolifèrent et se différencient en plasmocytes à longue durée de vie sécréteurs d’immunoglobulines ou en lymphocytes B mémoire. Dans le centre germinatif, les gènes des immunoglobulines subissent des hypermutations somatiques améliorant l’affinité des lymphocytes pour leur antigène.
Les immunoglobulines (Ig) sont des glycoprotéines ayant fonction d’anticorps, c'est-à-dire capable de se lier spécifiquement à un déterminant antigénique unique (épitope). Ce sont les effecteurs solubles de l’immunité humorale spécifique. Les immunoglobulines présentent deux extrémités variables identiques et propre à chaque Ig, capable de se lier à deux épitopes identiques; et une partie constante (Fc, fragment constant), qui peut être libre en circulation ou intégrée dans la membrane du lymphocyte B formant alors le BCR. Une des fonctions effectrices possibles portée par le Fc lorsque l’Ig est lié à un antigène est le déclenchement de l’ADCC (cytotoxicité dépendant des anticorps). Le Fc interagit avec le FcR (récepteur du Fc) présent sur les cellules NK, les macrophages, les polynucléaires. Ceci déclenche un mécanisme de lyse des cellules NK (identique à celui les LT CD8 décrit plus haut) faisant intervenir le système perforine-granzyme.
2.2 Echappement [4]
Le système immunitaire va sélectionner des variant tumoraux par une pression de sélection, résistants à l’attaque immunologique par différents mécanismes décrits ci après.
Les cellules tumorales peuvent perdre l’expression des antigènes tumoraux, ou perdre leur capacité de présentation aux lymphocytes par la perte des molécules du CMH. Elles peuvent augmenter leur expression de molécules anti-apoptotiques (bcl-2) ou augmenter leur production de molécules immunosuppressives comme le TGFβ, l’IL-10, l’IDO (Indoleamine 2,3-DiOxygenase).
On peut aussi noter un recrutement par les cellules tumorales dans le micro environnement de cellules suppressives: macrophages de type M2 (qui produisent de l’IL-10 et du TGFβ), LT régulateurs (mécanisme décrit plus haut), cellules myéloïdes suppressives… Ces cellules suppressives inhibent l’activité des lymphocytes infiltrant les tumeurs et produisent des facteurs de croissance favorisant la prolifération tumorale et peuvent aussi produire des molécules pro-angiogéniques.
Enfin, les cellules tumorales peuvent exprimer à leur surface des molécules favorisant l’épuisement des lymphocytes, c'est-à-dire les ligands (Fas-L, PD-L1, PD-L2, galectine-9…) des molécules de co-stimulation inhibitrices exprimées à la surface des lymphocytes T ou d’autres cellules immunitaires (PD-1, CTLA-4, Tim-3, Lag-3, CD96, Tigit, CD160, BTLA, Vista…). Certains ligands (CD80/CD86) peuvent être partagés par des récepteurs activateurs et inhibiteurs entrainant des phénomènes de compétition où l’avidité des différents ligands pour leur récepteur est importante. Par exemple, l’avidité de CTLA-4 pour CD80/CD86 est plus élevée que celle de CD28. L’interaction des molécules de costimulation inhibitrice avec leur ligand entraine la contraction clonale et l’activité suppressive des lymphocytes. Cet état est réversible après le blocage des signaux inhibiteurs, ce qui en fait la cible de nombreux traitement d’immunothérapie. Ces traitements n’induisent pas une réponse immunitaire antitumorale de novo mais l’amplifient en levant l’état d’anergie des cellules immunitaires préexistantes.
Par ailleurs, l’état d’inflammation chronique peut favoriser le développement ou la progression des tumeurs. Certaines cellules immunitaires jouent un rôle important dans l’inflammation chronique, c’est le cas des macrophages et des polynucléaires. Ils vont sécréter des facteurs de croissance qui vont servir le développement tumoral: Epidermal Growth Factor (EGF), des facteurs pro angiogéniques Vascular Endothélial Growth Factor (VEGF), des enzymes qui dégradent la matrice (matrix metallopeptidase 9 MMP-9) et donc qui favorisent le front d’invasion tumoral, mais aussi des radicaux libres de l’oxygène (qui sont génotoxiques), des cytokines et des chimiokines qui amplifient l’inflammation.
3 Valeur pronostique du micro environnement immunitaire tumoral gastrique
3.1 TILs (Tumor Infiltrating Lymphocytes) et expression de PD-1/PD-L1
Les lymphocytes infiltrant la tumeur (TILs) comprennent la présence de lymphocytes T (T cytotoxiques CD8, T auxiliaires CD4, T mémoires, T régulateurs), de lymphocytes B, et de lymphocytes NK. Ceux-ci sont reconnus par des antigènes de membrane spécifiques (CD3, CD4, CD8, FoxP3, CD20 et CD57). On peut distinguer les TILs intra tumoraux et les TILs du stroma. Dans le cancer gastrique, l’évaluation des TILS comme marqueur pronostique donne des conclusions contradictoires, qui peut être dû au fait que cela comprend plusieurs sous types de cellules immunitaires ayant elles-mêmes des rôles différents sur le pronostic.
La densité de lymphocytes intra tumoraux en coloration standard a été évaluée sur 54 pièces tumorales de cancer gastrique et n’a pas montré de différence sur la survie [7]. Le nombre de lymphocytes NK (CD57+) a été évalué sur 146 pièces tumorales et classé en forte ou faible infiltration avec un seuil à 25 NK/ HPF. Une forte infiltration était corrélée à des stades plus précoces de cancer, moins d’adénopathies métastatique et à une meilleure survie à 5 ans, non retrouvée en analyse multivariée [8]. L’expression de PDL-1 et la densité de TILs par immunohistochimie sur 398 tissus de cancer gastrique a montré qu’une forte densité de TILs était corrélée à une meilleure survie et que la positivité de PDL-1 (≥5%) était corrélée à une plus forte densité de TILs. Un sous groupe a été analysé montrant que la présence d’EBV était corrélée à la positivité pour PDL-1 et à une plus forte densité de TILs [9]. Un fort infiltrat de lymphocytes T Reg (FOXP3+) dans le stroma était associé à une meilleur survie sans progression qu’en cas de faible présence de T Reg dans des cancers du cardia [10], et une forte expression de T Reg intratumoraux était corrélée à une moins bonne survie sans progression, plus d’adénopathies métastatiques et était un facteur pronostique indépendant en multivarié, sur 133 cancers gastriques [11]. Une augmentation du rapport lymphocytes T reg/lymphocytes T CD8 intratumoral était corrélée à une moins bonne survie globale chez des patients opérés de cancer gastrique, mais l’infiltration intra tumorale de LT CD4 ou CD8 n’était pas corrélée à la survie [12]. A contrario, les lymphocytes CD8+ (de même que les CD3+ et les CD45RO+) intratumoraux étaient des facteurs pronostiques indépendants sur 220 cancers gastriques [13]. Il a été observé une plus forte proportion de lymphocytes T CD4+ PD1+ et Tim3+ intratumoraux dans le cancer gastrique que dans le tissu périphérique ou circulant, et le blocage ex vivo de ces molécules a restauré la production d’IFNγ par les lymphocytes T [14]. Une méta analyse portant sur 3291 patients a montré une grande variabilité de l’expression de PD-L1, allant de 14,3% à 69,4%, qui s’explique pour partie par les différences de seuil utilisé (de >1% à >50%) [15]. L’impact de cette expression montre des résultats discordants.
Plus récemment, une évaluation du micro environnement tumoral des cancers gastriques par estimation de la population cellulaire immunitaire et stromale par analyse génétique a été publiée, permettant la distinction de 22 phénotypes de cellules immunitaires (CIBERSORT algorithm) [16]. Trois profils ont été identifiés (TME score), dont le score élevé montrait une activation immune, associée à un meilleur pronostic de ce cancer [17].
Il a été montré que la densité de cellules dendritiques infiltrant la tumeur était corrélée au stade et au pronostic des cancers gastriques. Notamment, les patients avec une forte densité de cellules dendritiques présentaient une augmentation de leur survie globale par rapport aux patients avec une faible densité de cellules dendritiques [8].
3.3 TAMs (Tumor Associated Macrophages)
Une forte densité en macrophages M2 au sein de la tumeur a été associée à une survie moins bonne dans plusieurs cancers solides, y compris les cancers gastriques [18]. La coexistence de TAMs et de TGF-β est associée à des cancers plus agressifs. L’infiltration par les macrophages M1 semble au contraire associée à de meilleurs taux de survie [19].
3.4 Microenvironnement tumoral immunitaire selon la classification moléculaire TCGA
Le Cancer Genome Atlas Network (TCGA) a classifié les cancers gastriques en 4 profils: Epstein Barr positifs (EBV+) (9%), instabilité microsatelitaire (MSI) (22%), instabilité chromosomique (CIN) (50%) et génome stable (GS) (20%) [20]. Les tumeurs MSI et EBV+ ont été identifiées comme prédictives de réponse aux IPC [21]. L’analyse du micro environnement immunitaire dans chaque catégorie TCGA a été réalisée par l’équipe de Derk [22] par analyse immuno-génomique et en immunohistochime. L’infiltration en LT CD8 était importante pour les sous types EBV+ et MSI, et plus faible pour les CIN et GS. La répartition spatiale des CD8 a montré que leur densité était plus importante au centre de la tumeur par rapport au front d’invasion (ratio >1) pour le groupe EBV+, a contrario de la plupart des tumeurs CIN. La positivité de PDL1 (≥1%) (pour les cellules tumorales et/ou du microenvironnement) était de 86% pour les MSI, 69% pour les EBV, 61% pour les CIN et 6% pour les GS. Le groupe CIN avait la plus faible densité de LTh1, et moins de LT NK et de LTReg, par rapport aux MSI et EBV+. Il a été identifié un groupe de tumeur « CIN chaudes » ayant une plus forte présence de LT CD4 et CD8 par rapport au groupe « CIN froides ». Une amplification de MYC était associée à une présence plus faible de LT CD4 et CD8. Il n’y avait pas de différence sur l’âge, le genre, le stade tumoral ou la survie entre les tumeurs « CIN chaude » ou « froides », mais l’origine géographique d’Australie, Amérique du Nord et Europe de l’Ouest était plus fréquente pour les tumeurs « CIN chaudes ». Les tumeurs GS étaient pour partie enrichies en structures lymphoïdes tertiaires et notamment en cellules dendritiques.
Les macrophages M1 étaient plus fréquents dans les tumeurs MSI et CIN, et l’expression de PDL-1 par les TAMs était plus faible pour les tumeurs GS, sans pour autant de différence de pronostic [23].
4 Valeur pronostique du micro environnement immunitaire tumoral de l’hépatocarcinome
Dans le carcinome hépato cellulaire (CHC), l’expression de PDL1 par les cellules tumorales est faible (environ 10%) [24] et très hétérogène. Dans les essais CheckMate040 [25] et Keynote224 [26], l’expression de PD-L1 n’était pas un biomarqueur efficace. Des cellules hôtes non tumorales peuvent aussi exprimer PD-L1. Plusieurs séries montrent que l’expression de PD-1 par des cellules de l’immunité innée ont un effet inhibiteur sur les fonctions cytotoxiques des LT CD8 [27,28].
4.2 Charge mutationnelle (Tumor Mutational Burden)
La charge mutationnelle est corrélée à la réponse aux IPC dans de multiples cancers, y compris le CHC. Les tumeurs à forte charge mutationnelle ont plus de néo antigènes et sont liées à une plus forte infiltration immunitaire du micro environnement tumoral, une plus forte expression d’IFNγ et de PD-L1. Le niveau de charge mutationnelle est considéré comme modéré dans le CHC, avec un taux de réponse modérée aux IPC [29] mais une petite série indépendante de 17 CHC n’a pas montré d’association entre charge mutationnelle et réponse [30].
La densité de TILs (Tumor Infiltrating Lymphocytes), particulièrement des LT CD8+ est liée à un meilleur pronostic dans divers types de cancers, y compris les CHC. Il a aussi été montré qu’une densité plus importante de ces LT CD8+ était associée à une meilleure survie après IPC. La présence de lymphocytes T CD8 activés avec forte expression de XCL1 était corrélée à de meilleurs taux de survie pour des CHC viro-induits [31]. La densité de LT NK intra tumoraux et l’IFNγ étaient corrélés, seuls et en association, à une meilleure survie sans progression et survie globale en analyse multivariée du pronostic de 224 CHC opérés [32]. L’interaction entre les cellules de l’immunité innée et les lymphocytes T contribue à l’échappement immunitaire des CHC par la régulation négative des LT CD8. Par exemple, les macrophages M2 inhibent la prolifération des LT CD8 via les cytokines IL-6, G-CSF et MIP-2 (macrophage inflammatory proteins-2) [33]. La fonction protectrice des LT CD4 dans la carcinogenèse du CHC a été montrée sur la souris. Les L Treg inhibent la réponse des LT via l’IL-6 et l’IL-17 et sont associés à un mauvais pronostic [34].
Un sous type de macrophage M2 avec une forte expression de CCL18 était fortement représenté dans les CHC avancés viro-induits, dans une analyse du microenvironnement immunitaire par séquençage d’ARN sur foie tumoral et foie non tumoral lié au VHB/VHC [23]. Il a été montré que les TAMs favorisaient l’expansion métastatique des CHC en favorisant un environnement hypoxique via les marqueurs de signalisation HIF-1α et IL-1β [35]. Le rôle antitumoral des macrophages M1 a été montré dans certaines études [36], mais reste incertain puisqu’un autre travail a montré que les macrophages M1 promotaient l’expression de PDL-1 sur les cellules tumorales via l’IL-1β, ce qui va plutôt dans le sens protumoral des macrophages M1 [27].
Les interactions entre les cellules tumorales et le micro environnement tumoral sont complexes et multiples. Les thérapies actuelles inhibant les points de contrôle immunitaire ne ciblent qu’un des moyens d’échappement de la tumeur. Les signes d’activation immunitaire dans le micro environnement tumoral semblent être associés à un meilleur pronostic propre de la tumeur, mais on ne sait pour l’instant pas prédire l’efficacité des immunothérapies avec des biomarqueurs efficace. Ceci souligne la nécessité de travaux fondamentaux pour identifier les marqueurs d’efficacité des immunothérapies et ainsi d’identifier de nouvelles cibles thérapeutiques pour contourner ces mécanismes de résistance.
Funding Statement: The author(s) received no specific funding for this study.
Conflicts of Interest: Pierre-Guillaume Poureau: Investigator for MSD, Servier, Atrzaeneca, BeiGene studies, Invitation to congress from Servier, Fees from Sanofi, Bayer for particpation to boards. Jean-Philippe Metges: Investigator for MSD, Servier, Atrzaeneca, BeiGene, Roche studies, Invitation to congress from MSD, Fees from Sanofi, Bayer, Roche for particpation to boards, Editor in chief of ONCOLOGIE journal (ISSN: 1292-3818 Print, ISSN: 1765-2839 Online).
1. Kato, K., Sun, J. M., Shah, M. A., Enzinger, P. C., Adenis, A. et al. (2020). Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: The phase 3 KEYNOTE-590 study. Abstract LBA8_PR, ESMO congress 2020. Annals of Oncology, 31(4), S1142–S1215. DOI 10.1016/j.annonc.2020.08.2237. [Google Scholar] [CrossRef]
2. Kojima, T., Shah, M. A., Muro, K., Francois, E., Adenis, A. et al. (2020). Randomized phase III KEYNOTE-181 study of pembrolizumab versus chemotherapy in advanced esophageal cancer. Journal of Clinical Oncology, 38(35), 4138–4148. DOI 10.1200/JCO.20.01888. [Google Scholar] [CrossRef]
3. Finn, R. S., Qin, S., Ikeda, M., Galle, P. R., Ducreux, M. et al. (2020). Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. New England Journal of Medicine, 382(20), 1894–1905. DOI 10.1056/NEJMoa1915745. [Google Scholar] [CrossRef]
4. Carcelin, G., Chevailler, A., Fournel, S., Gubler, B., Lelièvre, J. D. et al. (2018). Immunologie fondamentale et immunopathologie, 2e édition, de l’ASSIM: Collège des Enseignants d’Immunologie ©. Elsevier Masson, Issy- les-Moulineaux. [Google Scholar]
5. Hanahan, D., Weinberg, R. A. (2000). The hallmark of cancer. Cell, 100(1), 57–70. DOI 10.1016/S0092-8674(00)81683-9. [Google Scholar] [CrossRef]
6. Dunn, G. P., Bruce, A. T., Ikeda, H., Old, L. J., Schreiber, R. D. (2002). Cancer immunoediting: From immunosurveillance to tumor escape. Nature Immunology, 3(11), 991–998. DOI 10.1038/ni1102-991. [Google Scholar] [CrossRef]
7. Dirican, A., Ekinci, E., Avci, A., Akyol, M., Alacacioglu, A. et al. (2013). The effects of hematological parameters and tumor-infiltrating lymphocytes on prognosis in patients with gastric cancer. Cancer Biomarkers, 13(1), 11–20. DOI 10.3233/CBM-130331. [Google Scholar] [CrossRef]
8. Ishigami, S., Natsugoe, S., Tokuda, K., Nakajo, A., Che, M. et al. (2000). Prognostic value of intratumoral natural killer cells in gastric carcinoma. Cancer, 88(3), 577–583. DOI 10.1002/(SICI)1097-0142(20000201)88:3<577::AID-CNCR13>3.0.CO;2-V. [Google Scholar] [CrossRef]
9. Dai, C. Q., Geng, R. X., Wang, C. C., Wong, A., Qin, M. et al. (2016). Concordance of immune checkpoints within tumor immune contexture and their prognostic significance in gastric cancer. Molecular Oncology, 10(10), 1551–1558. DOI 10.1016/j.molonc.2016.09.004. [Google Scholar] [CrossRef]
10. Haas, M., Dimmler, A., Hohenberger, W., Grabenbauer, G. G., Niedobitek, G. et al. (2009). Stromal regulatory T-cells are associated with a favourable prognosis in gastric cancer of the cardia. BMC Gastroenterology, 9(1), 65. DOI 10.1186/1471-230X-9-65. [Google Scholar] [CrossRef]
11. Zhou, S., Shen, Z. B., Wang, Y. N., Ma, H. Y., Xu, S. C. et al. (2013). CCR7 expression and intratumoral FOXP3+ regulatory T cells are correlated with overall survival and lymph node metastasis in gastric cancer. PLoS One, 8(9), 74430. DOI 10.1371/journal.pone.0074430. [Google Scholar] [CrossRef]
12. Shen, Z. B., Zhou, S., Wang, Y. N., Li, R. L., Zhong, C. P. et al. (2010). Higher intratumoral infiltarted Foxp3+ Treg number and Foxp3+/CD8+ ratio are associated with adverse prognostis in resectable gastric cancer. Journal of Cancer Research and Clinical Oncology, 136(10), 1585–1595. [Google Scholar]
13. Lee, H. E., Chae, S. W., Lee, Y. J., Kim, M. A., Lee, H. S. et al. (2008). Prognostic implications of type and density of tumour-infiltrating lymphocytes in gastric cancer. British Journal of Cancer, 99(10), 1704–1711. DOI 10.1038/sj.bjc.6604738. [Google Scholar] [CrossRef]
14. Yuan, L., Xu, B. L., Yuan, P., Zhou, J. X., Qin, P. et al. (2017). Tumor infiltrating CD4+T cells in patients with gastric cancer. Cancer Cell International, 17(1), 114. DOI 10.1186/s12935-017-0489-4. [Google Scholar] [CrossRef]
15. Gu, L. H., Chen, M. M., Guo, D. Y., Zhu, H. P., Zhang, W. C. et al. (2017). PD-L1 and gastric cancer prognosis: A systematic review and meta-analysis. PLoS One, 12(8), e0182692. DOI 10.1371/journal.pone.0182692. [Google Scholar] [CrossRef]
16. Becht, E., Giraldo, N. A., Lacroix, L., Buttard, B., Elarouci, N. (2016). Estimating the population abundance of tissue-infiltrating imune and stromal cell population using gene expression. Genome Biology, 17(1), 218. DOI 10.1186/s13059-016-1070-5. [Google Scholar] [CrossRef]
17. Zeng, D. Q., Li, M. Y., Zhou, R., Zhang, J. W., Sun, H. Y. et al. (2019). Tumor microenvironment characterization in gastric cancer identifies prognostic and immunohterapeutically relevant gene signatures. Cancer Immunology Research, 7(5), 737–750. DOI 10.1158/2326-6066.CIR-18-0436. [Google Scholar] [CrossRef]
18. Zhang, Q. W., Liu, L., Gong, C. Y., Shi, H. S., Zeng, Y. H. et al. (2012). Prognostic signifiance of tumor-associated macrophages in solid tumor: A meta analysis of the literature. Plos One, 7(12), e50946. DOI 10.1371/journal.pone.0050946. [Google Scholar] [CrossRef]
19. Wang, X. L., Tiang, J. T., Wu, C. P. (2016). Prognosis significance of tumor-associated macrophage infiltration in gastric cancer: A meta-analysis. Genetics and Molecular Research, 15(4), gmr15049040. [Google Scholar]
20. The Cancer Genome Atlas Research Network (2014). Comprehensive molecular characterization of gastric adenocarcinoma. Nature, 513, 202–209. [Google Scholar]
21. Kim, S. T., Cristescu, R., Bass, A. J., Kim, K. M., Odegaard, J. I. et al. (2018). Comprehensive molecular characterization of clinical response to PD-1 inhibition in metastatic gastric cancer. Nature Medicine, 24(9), 1449–1458. DOI 10.1038/s41591-018-0101-z. [Google Scholar] [CrossRef]
22. Derks, S., de Klerk, L. K., Xu, X., Fleitas, T., Liu, K. X. et al. (2020). Characterizing diversity in the tumor-immune microenvironment of distinct subclasses of gastroesophageal adenocarcinomas. Annals of Oncology, 31(8), 1011–1020. DOI 10.1016/j.annonc.2020.04.011. [Google Scholar] [CrossRef]
23. Huang, Y. K., Wang, M., Sun, Y., Costanzo, N. D., Mitchell, C. et al. (2019). Macrophage spatial heterogeneity in gastric cancer defined by multiplex immunohistochemistry. Nature Communications, 10(1), 3928. DOI 10.1038/s41467-019-11788-4. [Google Scholar] [CrossRef]
24. Pinato, D. J., Mauri, F. A., Spina, P., Cain, O., Siddique, A. et al. (2019). Clinical implications of heterogeneity in PD-L1 immunohistochemical detection in hepatocellular carcinoma: The Blueprint-HCC study. British Journal of Cancer, 120(11), 1033–1036. DOI 10.1038/s41416-019-0466-x. [Google Scholar] [CrossRef]
25. El-Khoueiry, A. B., Sangro, B., Yau, T., Crocenzi, T. S., Kudo, M. et al. (2017). Nivolumab in patients with advanced hepatocellular carcinoma (ChekMate040An open label, non comparative, phase 1/2 dose escalation and expansion trial. Lancet, 389(10088), 2492–2502. DOI 10.1016/S0140-6736(17)31046-2. [Google Scholar] [CrossRef]
26. Zhu, A. X., Finn, R. S., Edeline, J., Cattan, S., Ogasawara, S. et al. (2018). Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (Keynote-224A non randomized, open label phase 2 trial. Lancet Oncology, 19(7), 940–952. DOI 10.1016/S1470-2045(18)30351-6. [Google Scholar] [CrossRef]
27. Zong, Z., Zou, J., Mao, R., Ma, C., Li, N. et al. (2019). M1 macrophages induce PDL-1 expression in hepatocellular carcinoma through IL-1β signaling. Frontiers in Immunology, 10, 1643. DOI 10.3389/fimmu.2019.01643. [Google Scholar] [CrossRef]
28. Lim, T. S., Chew, V., Sieow, J. L., Goh, S., Yeong, J. P. S. et al. (2015). PD-1 expression on dendritic cells suppresses CD8+T cell function and antitumor immunity. OncoImmunology, 5(3), e1085146. DOI 10.1080/2162402X.2015.1085146. [Google Scholar] [CrossRef]
29. Yarchoan, M., Hopkins, A., Jaffee, E. M. (2017). Tumor muational burden and response rate to PD-1 inhibition. New England Journal of Medicine, 377(25), 2500–2501. DOI 10.1056/NEJMc1713444. [Google Scholar] [CrossRef]
30. Ang, C., Klempner, S. J., Ali, S. M., Madison, R., Ross, J. S. et al. (2019). Prevalence of established and emerging biomarkers of immune checkpoint inhibitor response in advanced hepatocellular carcinoma. Oncotarget, 10(40), 4018–4025. DOI 10.18632/oncotarget.26998. [Google Scholar] [CrossRef]
31. Song, G. H., Shi, Y., Zhang, M. Y., Goswami, S. Afridi, S. et al. (2020). Global immune characterization of HBV/HCV-related hepatocellular carcinoma identifies macrophage and T-cell subsets associated with disease progression. Cell Discovery, 6(1), 90. DOI 10.1038/s41421-020-00214-5. [Google Scholar] [CrossRef]
32. Xiao, Y. S., Gao, Q., Xu, X. N., Li, Y. W., Ju, M. J. et al. (2013). Combination of intratumoral invariant natural killer T cells and interferon-gamma is associated with prognosis of hepatocellular carcinoma after curative resection. PLoS One, 8(8), e70345. DOI 10.1371/journal.pone.0070345. [Google Scholar] [CrossRef]
33. Li, X. G., Yao, W. B., Yuan, Y., Chen, P. Z., Li, B. et al. (2017). Targeting of tumor-infiltrating macrophages via CCL2/CCR2 signalling as a therapeutic strategy against hepatocellular carcinoma. Gut, 66(1), 157–167. DOI 10.1136/gutjnl-2015-310514. [Google Scholar] [CrossRef]
34. Zhang, H. R., Jiang, Z. Z., Zhang, L. Y. (2019). Dual effect of T helper cell 17 (Th17) and regulatory T cell (Treg) in liver pathological process: From occurrence to end satge of disease. International Immunopharmacology, 69(4), 50–59. DOI 10.1016/j.intimp.2019.01.005. [Google Scholar] [CrossRef]
35. Hong, G. Q., Cai, D., Gong, J. P., Lai, X. (2021). Innate immune cells and their interaction with T cells in hepatocellular carcinoma. Oncology Letters, 21(1), 57. DOI 10.3892/ol.2020.12319. [Google Scholar] [CrossRef]
36. Vitale, I., Manic, G., Coussens, L. M., Kroemer, G., Galluzzi, L. (2019). Macrophages and metabolism in the tumor microenvironment. Cell Metabolism, 30(1), 26–50. DOI 10.1016/j.cmet.2019.06.001. [Google Scholar] [CrossRef]
 | This work is licensed under a Creative Commons Attribution 4.0 International License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited. |