 Open Access
Open Access
REVIEW
Processus pour le développement d’une stratégie d’évaluation de la qualité de vie en cancer avancé pédiatrique
Process for Developing a Quality of Life Assessment Strategy in Advanced Pediatric Cancer
1 Département de Psychologie, Université de Montréal, Montréal, H3C 3J7, Canada
2 Centre de Recherche, Centre Hospitalier Universitaire (CHU) Sainte-Justine, Montréal, H3T 1C5, Canada
3 Centre de Psycho-Oncologie (CPO), CHU Sainte-Justine, Montréal, H3T 1C5, Canada
4 École de Travail Social, Université Laval, Québec, G1V 0A6, Canada
5 Département de Pédiatrie, Université de Montréal, Montréal, H3T 1C5, Canada
6 Département de Pédiatrie Générale, CHU Sainte-Justine, Montréal, H3T 1C5, Canada
7 Centre Mère-enfant Soleil, CHU de Québec-Université Laval, Québec, G1V 4G2, Canada
8 CHU de Québec-Université Laval, Québec, G1V 4G2, Canada
9 Patient Partenaire, CHU Sainte-Justine, Montréal, H3T 1C5, Canada
10 Département d’Hémato-OncologIe, CHU Sainte-Justine, Montréal, H3T 1C5, Canada
* Corresponding Author: Serge Sultan. Email:
Psycho-Oncologie 2024, 18(2), 127-135. https://doi.org/10.32604/po.2024.046496
Received 04 October 2023; Accepted 25 December 2023; Issue published 06 August 2024
RÉSUMÉ
En contexte de cancer avancé pédiatrique, c’est-à-dire quand les traitements visant le cancer ne sont pas efficaces, les soins offerts aux patients ont une visée palliative pour limiter les symptômes et optimiser la qualité de vie (QdV). Pour orienter ces soins, il est nécessaire de connaître et mesurer ce qui est important pour les jeunes dans cette situation. Malheureusement, il existe très peu d’outils disponibles. L’objectif de cet article est de décrire le processus de développement d’une nouvelle méthode d’évaluation de la QdV qui s’adresse spécifiquement au contexte de cancer avancé pédiatrique, le programme Advance QoL. Trois études précédentes réalisées dans notre équipe ont permis d’identifier sept domaines de QdV importants auprès de cette population et de développer l’outil Advance Quality of Life (QoL)—version parents/soignants. L’étude en cours vise à développer des versions autorapportées de l’outil Advance QoL pour les enfants (8–12 ans) et les adolescents (13–18 ans) atteints de cancer avancé. À l’issue de cette étape, l’outil Advance QoL sera disponible en trois versions (parents/soignants, enfants et adolescents) qui seront testées dans des études de validation. L’évaluation régulière de la QdV des jeunes atteints de cancer est un processus central dans le but de définir des cibles pour l’activité soignante et devrait être réalisée tout au long de la trajectoire, incluant le cancer avancé.Abstract
In pediatric advanced cancer, i.e., when cancer-targeted treatments are not effective, care provided to patients is of palliative nature. It aims at limiting symptoms and optimizing quality of life (QoL). To orient care, it is necessary to know and measure what is really important for young people. Unfortunately, tools are still scarce in this context. The aim of this paper is to describe the development process of a new QoL assessment method, the Advance QoL program. This is specifically designed for the clinical context of pediatric advanced cancer. Three previous studies carried out by our team identified seven important QoL domains for this population. We developed a tool named Advance QoL—parent/caregiver version. A current study aims to develop self-reported versions of the Advance QoL for children (8–12 years) and adolescents (13–18 years) with advanced cancer. In the very near future, the Advance QoL tool will be available in three versions (parents/caregivers, children, and adolescents) ready to be tested in validation studies. Regular assessment of the QoL of young people with cancer is a central process in defining targets for care and should be carried out throughout the trajectory, including when cancer is at an advanced stage, i.e., when no standard treatment options are available.MOTS CLÉS
Keywords
En pédiatrie, tout type de cancer confondu, le taux de survie à 5 ans est d’environ 83,0% (81,6%–84,4%) en Amérique du Nord, ce qui est similaire aux données rapportées dans les pays à haut revenu [1,2]. Il y a donc environ 17% des enfants et des adolescents atteints de cancer pour qui les traitements standards actuels ne permettent pas de guérison [1,3]. La maladie qui ne répond pas aux traitements et/ou qui est progressive ou récurrente, et dont la probabilité de guérison est faible est qualifiée « de cancer avancé ». Dans ces situations, les soins offerts s’orientent généralement sur des objectifs palliatifs afin d’optimiser la qualité de vie (QdV), le bien-être, et la diminution des symptômes [4–6] de l’enfant.
Pour orienter ces soins, il est nécessaire de connaître et mesurer ce qui est important pour les jeunes atteints de cancer avancé [7]. Nous devons disposer d’outils pour évaluer régulièrement et de manière valide ces aspects pour mettre en place des actions susceptibles de répondre aux besoins des patients et de leur famille [8,9].
Pour évaluer la QdV dans ce contexte, on doit néanmoins prendre en considération plusieurs contraintes comme la fatigabilité des jeunes et les changements rapides dans l’état santé. Deux revues systématiques ont montré que les outils d’évaluation de la QdV existants ont plusieurs limites lorsqu’utilisées auprès des jeunes atteints de cancer avancé [7,10]. Cinq critiques ont notamment été adressées. 1) Les qualités psychométriques des outils d’évaluation de la QdV en cancer avancé pédiatrique sont très peu documentées en raison des petits échantillons liés à divers enjeux de recrutement auprès de cette population vulnérable. L’absence de ces données peut rendre l’évaluation de la pertinence et de la qualité des outils difficile, et peut remettre en question leur utilisation en milieu clinique. 2) Les jeunes patients, les parents et les professionnels de la santé sont peu impliqués dans l’élaboration des outils de la QdV, ce qui amène des lacunes sur le plan de la validité des outils ainsi que des difficultés d’implantation des outils dans les milieux cliniques. Par exemple, les items du Pediatric Advanced Care Quality of Life Scale (PAC-QoL) [11] ont été développés à partir de la littérature, alors que les dimensions de la QdV les plus importantes pour les enfants atteints de cancer avancé ne sont pas connues actuellement. 3) La période de rappel des outils est parfois inappropriée ou trop longue pour les jeunes. Leur état de santé, leur bien-être et les symptômes associés à la maladie peuvent changer rapidement, ce qui nécessite une période de rappel brève afin d’être sensible à ces changements en plus d’être facilitant pour les jeunes. 4) Les dimensions évaluées dans les outils peuvent être inappropriées au contexte clinique de cancer avancé. Par exemple, une étude a montré que certains items du Pediatric Quality of Life Inventory™ (PedsQL™) [12] évaluant le fonctionnement physique n’étaient pas applicables auprès d’environ 15% des jeunes ayant une condition limitant l’espérance de vie [13]. Enfin, les outils génériques ne permettent pas d’évaluer pleinement les impacts spécifiques du cancer avancé sur le bien-être des jeunes. Les outils spécifiques devraient être privilégiés auprès de cette population alors qu’aucun n’a été développé spécifiquement pour un usage auprès des jeunes atteints de cancer avancé. 5) L’évaluation des symptômes uniquement (p. ex., le Pediatric Memorial Symptom Assessment Scale [PQ-MSAS; 14]) peut entraîner un manque de couverture des thèmes importants de la QdV dans un contexte où les symptômes ne résument pas tout. Enfin, parmi les outils recensés par Coombes et ses collaborateurs (2016), tous les outils ont d’abord été développés en anglais. À notre connaissance, très peu de ces outils possèdent une adaptation francophone validée. En somme, les résultats des deux revues systématiques montrent qu’aucun outil existant ne permet d’évaluer de façon optimale la QdV des jeunes atteints de cancer avancé en soins palliatifs pédiatriques (SPP) [7,10]. Il est donc crucial de développer de nouveaux outils d’évaluation de la QdV pertinents et utiles pour cette population avant d’en démontrer la fidélité et la validité de contenu [7,10,15].
Le présent article vise à décrire le processus de développement d’une méthode nouvelle pour évaluer la QdV qui s’adresse spécifiquement au contexte de cancer avancé pédiatrique, le programme Advance QoL.
La Fig. 1 illustre le processus de développement d’outils de collecte autorenseignés (Patient-Reported Outcomes) en pédiatrie [16]. Il a été inspiré du processus itératif suggéré par la Food and Drug administration [FDA, 17]. Pendant tout ce processus, il est fortement recommandé d’inclure des patients et des professionnels de la santé [7,16].
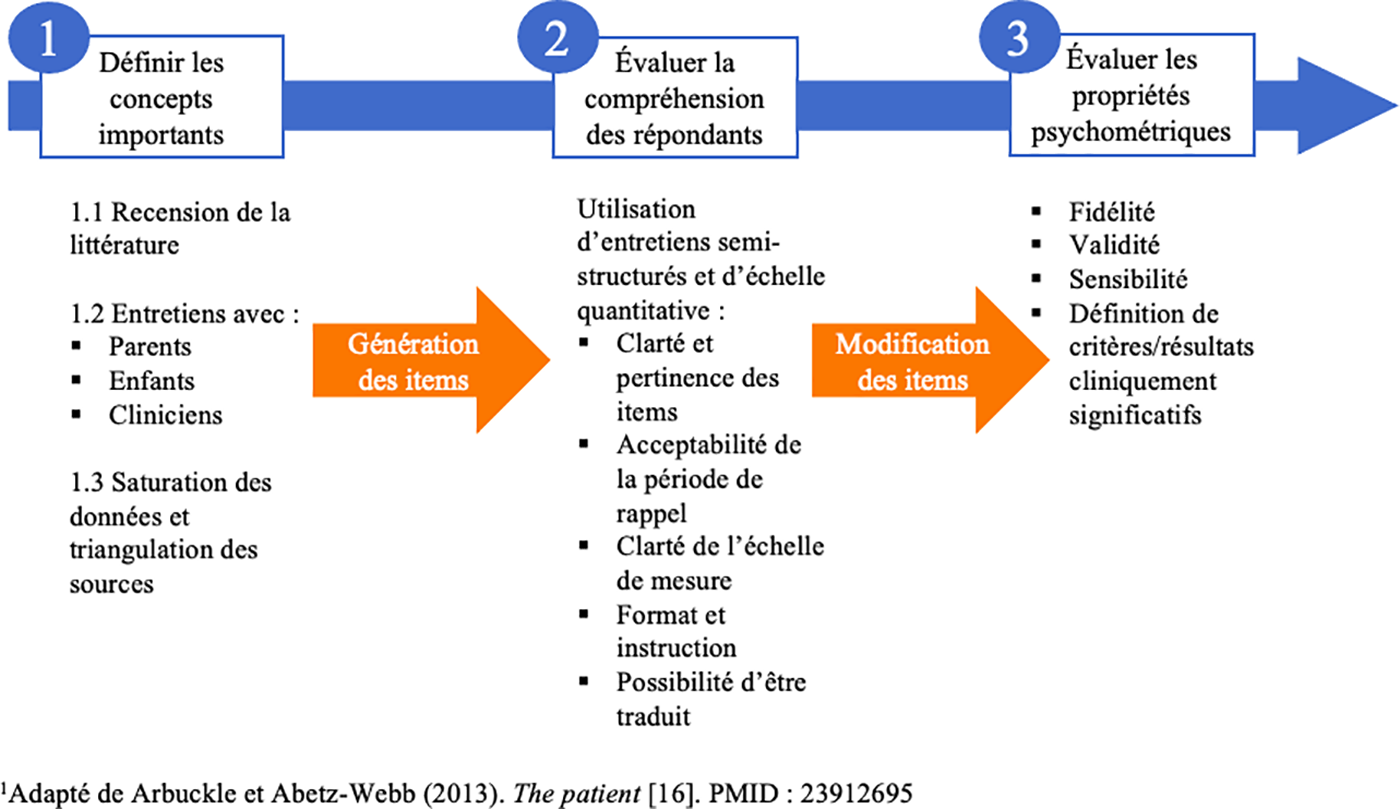
Figure 1: Processus de développement d’outils de collecte autorenseignés (patient-reported outcomes) en pédiatrie1.
Puisque les données manquantes sont un enjeu fréquent en oncologie pédiatrique, il est essentiel de mettre en place des stratégies pour prévenir, minimiser et gérer ce phénomène [18]. Respecter un processus rigoureux appuyé par les données probantes permettrait de minimiser les données manquantes [19] et de s’assurer que les outils développés soient adaptés à la population ciblée [16].
L’élaboration d’un cadre conceptuel appuyé par les données probantes constitue la première étape de développement d’un questionnaire [20]. Cette étape permet de cibler et définir les concepts importants à évaluer [16]. Sur la base des informations recensées, des items pour développer un nouvel outil sont ensuite générés. Par la suite, il est nécessaire d’assurer la compréhension de l’outil auprès des répondants. Pour ce faire, il est possible d’utiliser des entretiens cognitifs semi-structurés qui permettent de collecter l’avis et l’expérience des répondants afin d’améliorer la conception de l’outil [16,21–23]. Cela donne un accès privilégié au processus de pensée et à la compréhension des répondants, et permet d’identifier des difficultés potentielles liées à la compréhension et à l’usage de l’outil [22,23]. L’accès à la perspective et le sens que donnent les répondants à l’outil sont essentiels au processus de conception d’outils [24]. Ce dernier point est un enjeu particulièrement important en pédiatrie et auprès des populations vulnérables.
En plus d’évaluer la clarté et la compréhension, il est nécessaire d’évaluer la pertinence, l’acceptabilité et la satisfaction de l’outil, soit la validité sociale de l’outil [25–27]. La validité sociale peut être mesurée de façon subjective à l’aide d’un questionnaire de satisfaction, ce qui permet d’obtenir des données quantitatives reflétant l’opinion des répondants [27]. Les informations recueillies permettent notamment d’identifier les possibles barrières à l’utilisation. L’évaluation de la validité sociale permet ensuite d’élaborer des procédures pertinentes, appropriées, et acceptables pour améliorer la qualité de vie des usagers [25].
La combinaison de plusieurs méthodes (c.-à-d., des entrevues, une recension de littérature et l’obtention d’opinion d’expert) pour développer un outil favorise l’élaboration d’un outil complet et adapté à la population et au contexte ciblé [28]. Ces différentes phases permettant un développement conceptuel et méthodologique rigoureux pour les nouveaux outils ont été utilisées dans le cadre du programme Advance QoL. Dans les paragraphes suivants, nous présentons les étapes franchies et le travail en cours pour élaborer le nouvel outil d’évaluation de la QdV Advance QoL.
Identifier et Décrire les Dimensions de la QdV
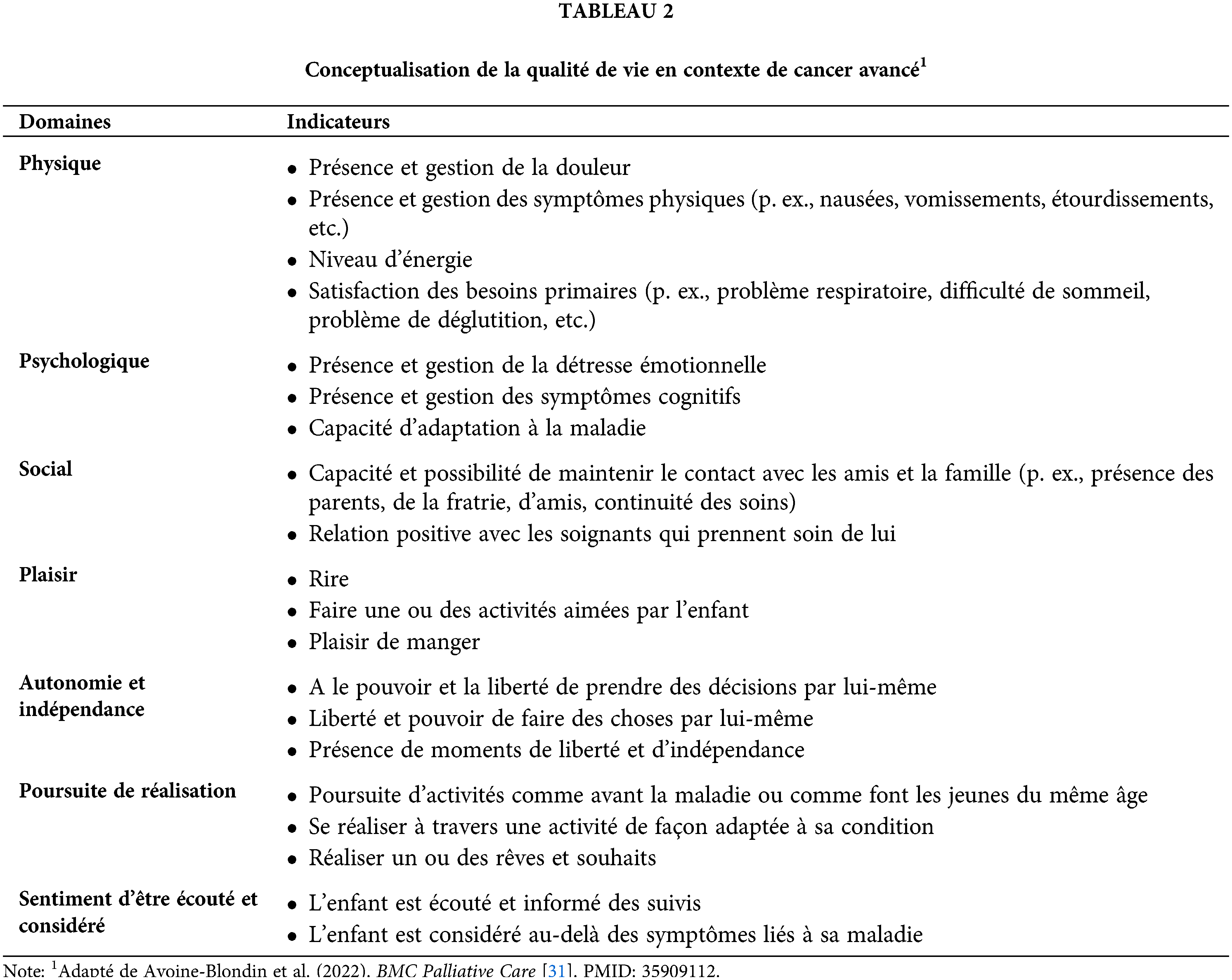
Il existe plusieurs définitions de la QdV et de la QdV liée à la santé (health-related quality of life). Toutefois, les dimensions importantes pour définir la QdV des enfants et adolescents atteints de cancer avancé étaient inconnues au début du programme de recherche [7]. Sans la perspective de la population cible, il n’était pas possible de savoir si les thèmes rapportés dans la littérature étaient appropriés au contexte clinique spécifique ou s’il offrait une vision réduite de leur QdV. La première étude a donc visé à opérationnaliser la QdV spécifiquement en contexte de cancer avancé pédiatrique (Tableau 1) [30]. Des entrevues semi-structurées menées auprès de soignants actifs en soins palliatifs ont permis d’identifier sept domaines de la QdV importants pour cette population : le confort physique, le soulagement de la souffrance psychologique, des relations sociales significatives, le plaisir et le moment présent, le sentiment de contrôle, le sentiment que la vie continue, et le sentiment d’être valorisé et apprécié.
La deuxième étude a visé à recueillir la perspective des jeunes atteints de cancer avancé et de leurs parents sur la QdV [31]. Des entrevues semi-structurées individuelles ont été réalisées pour obtenir leur perspective respective de la QdV en cancer avancé pédiatrique. Les données obtenues ont été comparées à la perspective des soignants, ce qui a permis d’enrichir et de raffiner les sept dimensions de la QdV précédemment identifiées. Les triangulations des résultats a permis de définir les dimensions suivantes : « physique, psychologique, social, plaisir, autonomie et indépendance, poursuite de réalisations, et sentiment d’être écouté et considéré ». La triangulation des informations provenant des différents répondants (soignants/parents/jeunes) a permis d’opérationnaliser la QdV en fonction de ce qui est important dans la vie des jeunes atteints de cancer avancé. Différents indicateurs de ces dimensions ont été générés à partir des discours (Tableau 2). Ceux-ci se basent sur l’expérience partagée des patients, des parents et des soignants. Pour les rendre opérationnels, les domaines et les indicateurs ont été reformulés à partir du discours des jeunes et des parents, ce qui permet notamment d’éviter l’usage de jargon scientifique. Par exemple, la dimension « sentiment de contrôle » précédemment identifiée par les soignants a été remplacée par « autonomie », ce qui facilitait la compréhension auprès des jeunes et des parents. Cette première définition opérationnalisée de la QdV élaborée spécifiquement pour cette population a permis de fournir un vocabulaire accessible pour les différents répondants. Cela vise à faciliter la communication entre les différents répondants en fournissant un langage commun compris de tous sur lequel chacun peut comprendre la même chose. Une tonalité positive a été mise de l’avant pour avoir une perspective centrée sur les capacités au-delà de l’absence de symptômes et de déficit, en cohérence avec une perspective positive de la QdV [20]. Par exemple, la question suivante est posée aux parents/soignants : « En considérant les soins actuellement mis en place, j’estime que les dimensions suivantes contribuent positivement au bien-être du jeune ». Pour cerner le domaine du plaisir, les indicateurs sont : « 1) Avoir eu l’occasion de faire une activité qu’il/elle aime (p. ex., dessiner, écouter de la musique, aller au cinéma, partager un moment de plaisir, etc.) ; 2) Manger quelque chose qu’il/elle aime (p. ex., son repas préféré, etc.). »
Développer un Outil D’évaluation de la QdV
Une troisième étude a visé à développer une première version de l’outil appelé dorénavant Advance QoL (Quality of Life). Cet outil a été développé en s’appuyant sur les sept dimensions de la QdV précédemment identifiées auprès des soignants, des enfants atteints de cancer avancé et de leurs parents [31]. L’outil est disponible pour consultation en français et en anglais (https://doi.org/10.1186/s12904-022-01025-z). Il s’agit d’une version pour les parents et les soignants visant à décrire la QdV des jeunes de façon quantitative et qualitative, et utilisant des items détaillés par domaine. Une étude de raffinement du contenu et du format avec 15 experts a été réalisée [31]. Dans sa version finale actuelle, les répondants doivent indiquer sur une échelle de 0 (En désaccord) à 2 (Tout-à-fait d’accord) si le domaine considéré influence positivement la QdV du jeune. La période de rappel réfère à un intervalle d’une journée ou à la dernière fois que le soignant a vu le jeune, et a été choisie selon les recommandations des professionnels de la santé en SPP [10,31,32]. Les répondants peuvent ensuite indiquer les raisons appuyant leurs réponses et ajouter des pistes d’amélioration. Enfin, ils peuvent rapporter le score de chaque dimension dans un diagramme étoilé pour faciliter le repérage visuel des dimensions de la QdV qui sont les plus basses ou les plus élevées chez le jeune.
Le format de l’outil tient compte des contraintes de la recherche auprès de cette population rare et vulnérable. Cet outil adopte une approche descriptive et individualisée pour répondre au besoin de cette population [7,10]. Puisque le recrutement est plus complexe et les échantillons sont généralement petits en cancer avancé pédiatrique, il est particulièrement difficile d’évaluer les propriétés psychométriques des outils [33]. Le développement d’un outil ayant une approche plus individualisée permet d’étudier et documenter la validité, la fidélité et la sensibilité d’une façon qui ne nécessite pas d’études de psychométrie avancée avec un grand échantillon [7,10,13].
Néanmoins, le langage utilisé dans cette version parents/soignants n’est pas approprié pour être directement lu et compris par un enfant ou un adolescent. Ainsi, la version adulte ne peut être utilisée comme outil autorapporté pour les jeunes. Pourtant, disposer de versions propres à collecter l’expérience subjective des jeunes est une nécessité [34]. Certaines informations subjectives ne sont connues que par le jeune, ce qui nécessite de le questionner directement [16]. La suite du programme de développement de Advance QoL a consisté à développer ce type de versions. La définition même de la QdV ainsi que les recherches en éthique clinique appuient la nécessité de solliciter la participation des parents dans les discussions portant sur les soins de leur enfant et dans le processus de prise de décisions [6,35]. L’utilisation de mesures « proxy » (comme celle des parents) est insuffisante et peut même manquer de validité pour évaluer des domaines décrivant des expériences internes (comme l’anxiété, la dépression et la détresse). L’évaluation que font les parents est également susceptible d’être influencée par leur propre état interne au moment de la complétion de la mesure [36].
Développement de versions autorapportées pour les enfants et adolescents
Ces versions autorapportées doivent prendre en considération le niveau de lecture des jeunes, leurs particularités linguistiques et leur niveau cognitif [18,37]. Par exemple, le langage doit être simple et direct, et éviter les doubles négations et les termes vagues [16]. Afin d’augmenter l’acceptabilité des outils et d’en favoriser la complétion, il est recommandé d’utiliser un visuel attrayant [21]. Il est aussi suggéré d’utiliser une écriture plus large et de disposer les éléments de façon claire pour faciliter la compréhension et la complétion des outils, des éléments souvent négligés [16].
Il est recommandé de disposer de versions adaptées à différentes tranches d’âges [16,18,21] pour que l’outil soit adapté au niveau développemental des jeunes et aux différences entre les enfants et les adolescents. Il est montré que ceux-ci peuvent avoir des préoccupations et une vision différente de leur QdV [12]. Ces versions offrent la possibilité de reconnaître les préférences et les expériences des jeunes, ce qui faciliterait leur inclusion dans les discussions entourant leur santé et leurs soins.
Dans le cadre du programme Advance QoL, une version pour les enfants (8–12 ans) et une version pour les adolescents (13–18 ans) de l’outil Advance QoL sont en cours d’élaboration, à partir de la version parents/soignants qui a été mise au point dans les études précédentes. Les tranches d’âge de chacune des versions ont été établies en fonction de celles utilisées dans d’autres outils très utilisés en QdV, comme le PedsQL™ [7,10,11,12]. Des versions préliminaires ont d’abord été développées en collaboration avec l’équipe de recherche qui inclut des professionnels de la santé, un patient partenaire et cinq jeunes collaborateurs issus de la population non clinique (9–16 ans, 4 filles). La lisibilité des outils a été vérifiée à l’aide de l’indice Scolarius [38]. Actuellement, nous menons une étude pour évaluer la compréhension des versions autorapportées de Advance QoL auprès des jeunes. Des entretiens cognitifs semi-structurés individuels sont réalisés auprès d’enfants et adolescents atteints d’un cancer. Cette méthode, valide dès l’âge de 8 ans, permet aux enfants de commenter l’outil, et de décrire leur santé et QdV de façon significative [39]. Les résultats préliminaires suggèrent une bonne compréhension des versions autorapportées ainsi qu’une bonne appréciation globale de l’outil [29]. Différents éléments ont été nommés comme facilitateurs (p. ex., l’utilisation de bonshommes sourire pour les enfants, la présence d’exemples et l’organisation des consignes). Différentes catégories de problèmes nuisant à la compréhension des outils ont également été recensées (p. ex., manque de précision, référence imprécise, élément manquant et mots ou concepts incompris). Nous évaluons également la validité sociale à l’aide d’un questionnaire de satisfaction de 10 items (1 = Pas du tout d’accord à 5 = Totalement d’accord) inspiré de Kazdin (2005) [40] et Manne et al. (2016) [41]. Parmi les items utilisés, il y a notamment « Je comprends bien ce qui est demandé. », « L’outil est facile à utiliser. », « L’outil est utile pour évaluer mon bien-être. », « La longueur du questionnaire est acceptable. » et « J’ai apprécié l’outil. » Ces items permettent d’évaluer la compréhension globale, la facilité d’utilisation, l’utilité, l’acceptabilité et l’appréciation de Advance QoL. Les résultats obtenus montrent une très bonne appréciation des adolescents (M = 4,81) et des enfants (M = 4,53). Aucun problème majeur n’a été soulevé: la correction des éléments problématique et le raffinement des outils permettront le développement final des versions autorapportées de l’outil Advance QoL (versions préliminaires disponibles au dépôt institutionnel: https://doi.org/10.5683/SP3/HXWTYJ). L’article de développement des versions enfants (8–12 ans)/adolescents (13–18 ans) est en cours de rédaction et les versions finalisées seront disponibles sur le même lien [29].
L’évaluation de la QdV rapportée par les patients est un processus central qui permet d’évaluer la perception de leur santé et bien-être dans le but de définir des cibles pour l’activité soignante. Cela est crucial dans une phase où l’accent est mis sur l’optimisation du confort dans un contexte où la maladie ne peut être guérie [42]. L’utilisation d’outils évaluant la QdV permet aux soignants d’avoir accès à des informations pouvant orienter des discussions cliniques, ce qui favorise la qualité des soins offerts et une bonne communication entre les soignants, les patients et leurs familles [20].
L’utilisation de mesures autorapportées de la QdV pour les jeunes avec un cancer avancé, comme Advance QoL, permet de reconnaître leur voix dans la planification des soins et les décisions quant à leur santé. Ils sont en effet tout à fait capables de parler de leurs symptômes et de leur QdV [35,39] et peuvent se forger une opinion et manifester leurs préférences quant à leurs soins [6,43]. L’implication des jeunes dans les discussions portant sur leurs intérêts, leurs choix et leurs soins favorise également le développement d’un sentiment de responsabilité personnelle [44], encourage leur autonomie et leur autodétermination [45,46]. Par contraste, la recherche montre que l’exclusion des jeunes dans les discussions quant à leur santé amène un sentiment d’isolation sociale et de détresse [47,48]. Leur participation pourrait faciliter l’identification des objectifs de soins adaptés ainsi que la communication intrafamiliale. Ceci aboutit généralement à diminuer le stress vécu [49,50]. Il est donc suggéré d’impliquer activement autant que possible les enfants et adolescents et de rechercher leur coopération volontaire dans la planification de leurs soins [6,43], même quand ils sont très malades.
Le développement des outils Advance QoL permet de répondre à un besoin exprimé par les soignants et repris dans les standards de soin en oncologie pédiatrique [7–9,32]. À l’issue de l’étape actuelle, l’outil Advance QoL sera disponible en trois versions (parents/soignants, enfants et adolescents) qui seront utilisées dans la suite du programme de recherche, puis implantées en clinique. L’implication des enfants, des parents et des soignants dans l’élaboration des outils permet d’assurer une excellente validité de la mesure et favorise le développement d’un instrument approprié au contexte unique de cette population vulnérable. Les recherches futures viseront à étudier les propriétés psychométriques de l’outil (fidélité interjuge, sensibilité et stabilité). Par la suite, nous encouragerons des études d’implantation de Advance QoL en milieu clinique et d’évaluation de la satisfaction, et des études centrées sur l’utilisation et les impacts de l’outil sur la gestion des cas. Une piste de développement concerne également le rôle de l’utilisation d’Advance QoL sur la communication. Notre espoir est que Advance QoL permette de cibler les interventions auprès des patients et de leur famille et d’améliorer les pratiques cliniques dans le but de mieux remplir le mandat des soins palliatifs pédiatriques qui vise l’optimisation de la Qualité de Vie.
Remerciements/Acknowledgment: Nous tenons à remercier tous les patients et leurs familles ainsi que les cliniciens qui ont offert de leur temps et de leur énergie aux différentes étapes du programme Advance QoL. Nous souhaitons également souligner l’aide précieuse que nous avons reçue au fil des années de la part de l’Équipe Espoir du CHU Sainte-Justine (CHUSJ), de l’équipe du Centre de jour d’hématologie-oncologie du CHUSJ, de la Clinique des tumeurs cérébrales du CHUSJ et de l’organisme Leucan. Nous remercions chaleureusement Josianne Avoine-Blondin qui a grandement contribué au programme Advance QoL pendant plusieurs années. Nous soulignons aussi l’implication des jeunes membres de l’équipe de recherche Léa-Rose Bouchard, Mathis Bouchard, Rose-Élyse Bouchard, Rosée-Lee Côté-Fournier et Jeanne Gosselin. Enfin, un grand merci à tous ceux et celles qui ont permis à ce programme de recherche de se développer et d’avancer.
Financements/Funding Statement: Le programme Advance QoL a été financé par la Fondation du CHU Sainte-Justine, par le Réseau québécois de recherche en soins palliatifs et de fin de vie (RQSPAL ; Projet pilote 2018), par la Fondation Coast-to-Coast Canada et par les Instituts de recherche en santé du Canada (IRSC).
Contributions des Auteurs/Author Contributions: Les auteurs confirment leur contribution à l’article comme suit : conception et design de l’étude : LAR, MODA, JF HFTE, MAM, BM, ER, MTG, MD, SS ; collecte de données : LAR, JF, MAM, BM, ER, MD ; analyses et interprétations des résultats : LAR, MODA, JF HFTE, MAM, BM, ER, MTG, MD, SS ; préparation du manuscrit : LAR, MODA, JF HFTE, MAM, BM, ER, MTG, MD, SS. Tous les auteurs ont révisé les résultats et approuvé la version finale du manuscrit.
Disponibilité des Données et du Matériel/Availability of Data and Materials: Les données seront fournies à la demande de l'auteur correspondant.
Avis Éthiques/Ethics Approval: Le présent article est une revue et n’inclut pas de sujets humains ou animaux. Les études révisées ont toutes été approuvées par le comité d’éthique du CHU Sainte-Justine #2017-1053, #2018-1871 et #MP-21-2022-3550.
Conflits D’intérêts/Conflicts of Interest: Les auteurs déclarent n’avoir aucun conflit d’intérêts à signaler concernant la présente étude. The authors declare that they have no conflicts of interest to report regarding the present study.
References
1. Comité Consultatif des Statistiques Canadiennes sur le Cancer, en Collaboration avec la Société Canadienne du Cancer, Statistique Canada et l’Agence de la Santé Publique du Canada. Statistiques Canadiennes sur le cancer. 2021. Novembre. Consultable sur : http://cancer.ca/Canadian-Cancer-Statistics-2021-FR. [Accessed 2021]. [Google Scholar]
2. Ward ZJ, Yeh JM, Bhakta N, Frazier AL, Girardi F, Atun R. Global childhood cancer survival estimates and priority-setting: a simulation-based analysis. Lancet Oncol. 2019;20(7):972–83. doi:10.1016/S1470-2045(19)30273-6. [Google Scholar] [PubMed] [CrossRef]
3. de Vries MC, Wit JM, Engberts DP, Kaspers GJ, van Leeuwen E. Pediatric oncologists attitudes towards involving adolescents in decision-making concerning research participation. Pediatr Blood Cancer. 2010;55(1):123–8. [Google Scholar] [PubMed]
4. Société canadienne du cancer. Cancer avancé. Consultable sur : https://cancer.ca/fr/living-with-cancer/advanced-cancer. [Accessed 2021]. [Google Scholar]
5. Baker JN, Levine DR, Hinds PS, Weaver MS, Cunningham MJ, Johnson L, et al. Research priorities in pediatric palliative care. J Pediatr. 2015;167(2):467–70.E3. doi:10.1016/j.jpeds.2015.05.002. [Google Scholar] [PubMed] [CrossRef]
6. Carnevale FA. Conclusion : Une perspective éthique sur le soutien aux familles d’enfants atteints de conditions chroniques complexes. In: Mongeau S, Champagne M, Lussier L, editors. Le so utien aux familles d’enfants gravement malades : regards sur des pratiques novatrices. Collection Problèmes sociaux et interventions sociales. vol. 61, Québec, Canada: Presses de l’Université du Québec ; 2014. p. 217. [Google Scholar]
7. Friedel M, Aujoulat I, Dubois A, Degryse J. Instruments to measure outcomes in pediatric palliative care: a systematic review. Pediatr. 2019;143(1):e20182379. doi:10.1542/peds.2018-2379. [Google Scholar] [PubMed] [CrossRef]
8. Kazak AE, Abrams AN, Banks J, Christofferson J, DiDonato S, Grootenhuis MA, et al. Psychosocial assessment as a standard of care in pediatric cancer. Pediatr Blood Cancer. 2015;62:426–59. doi:10.1002/pbc.25730. [Google Scholar] [PubMed] [CrossRef]
9. Wiener L, Kupst MJ, Pelletier W, Kazak AE, Thompson AL. Tools to guide the identification and implementation of care consistent with the psychosocial standards of care. Pediatr Blood Cancer. 2020;67(9):e28586. doi:10.1002/pbc.28586. [Google Scholar] [PubMed] [CrossRef]
10. Coombes LH, Wiseman T, Lucas G, Sangha A, Murtagh FE. Health-related quality-of-life outcome measures in paediatric palliative care: a systematic review of psychometric properties and feasibility of use. Palliat Med. 2016;30(10):935–49. doi:10.1177/0269216316649155. [Google Scholar] [PubMed] [CrossRef]
11. Cataudella D, Morley TE, Nesin A, Fernandez CV, Johnston DL, Sung L, et al. Development of a quality of life instrument for children with advanced cancer: the pediatric advanced care quality of life scale (PAC-QoL). Pediatr Blood Cancer. 2014;61(10):1840–5. doi:10.1002/pbc.25115. [Google Scholar] [PubMed] [CrossRef]
12. Varni JW, Seid M, Rode CA. The PedsQL: measurement model for the pediatric quality of life inventory. Med Care. 1999;37(2):126–39. [Google Scholar] [PubMed]
13. Huang IC, Shenkman EA, Madden VL, Vadaparampil S, Quinn G, Knapp CA. Measuring quality of life in pediatric palliative care: challenges and potential solutions. Palliat Med. 2010;24(2):175–82. doi:10.1177/0269216309352418. [Google Scholar] [PubMed] [CrossRef]
14. Wolfe J, Orellana L, Ullrich C, Cook EF, Kang TI, Rosenberg A, et al. Symptoms and distress in children with advanced cancer: prospective patient-reported outcomes from the PediQUEST study. J Clin Oncol. 2015;10(17):1928–35. doi:10.1200/jco.2014.59.1222. [Google Scholar] [PubMed] [CrossRef]
15. Anthony SJ, Selkirk E, Sung L, Klaassen RJ, Dix D, Klassen AF. Quality of life of pediatric oncology patients: do patient-reported outcome instruments measure what matters to patients? Qual Life Res. 2017;26(2):273–81. doi:10.1007/s11136-016-1393-4. [Google Scholar] [PubMed] [CrossRef]
16. Arbuckle R, Abetz-Webb L. “Not just little adults”: qualitative methods to support the development of pediatric patient-reported outcomes. Patient. 2013;6(3):143–59. doi:10.1007/s40271-013-0022-3. [Google Scholar] [PubMed] [CrossRef]
17. Food and Drug Administration. Guidance for industry: patient-reported outcome measures: use in medical product development to support labeling claims: draft guidance. Health Qual Life Outcomes. 2006;4(1):1–20. doi:10.1186/1477-7525-4-79. [Google Scholar] [PubMed] [CrossRef]
18. Bradlyn AS, Ritchey AK, Harris CV, Moore IM, O'Brien RT, Parsons SK, et al. Quality of life research in pediatric oncology. Research methods and barriers. Cancer. 1996;78(6):1333–9. [Google Scholar] [PubMed]
19. Geisen E, Bergstrom JR. Usability testing for survey research. Cambridge, MA: Morgan Kaufmann. Available from: https://www.sciencedirect.com/book/9780128036563/usability-testing-for-survey-research. [Accessed 2017]. [Google Scholar]
20. Soulas T, Brédart A. Qualité de vie et santé. In: Sultan S, Varescon I, editors. Psychologie de la Santé. vol. 17–40. Paris, France: Presses Universitaires de France; 2012. [Google Scholar]
21. Coombes L, Bristowe K, Ellis-Smith C, Aworinde J, Fraser LK, Downing J, et al. Enhancing validity, reliability and participation in self-reported health outcome measurement for children and young people: a systematic review of recall period, response scale format, and administration modality. Qual Life Res. 2021;30(7):1803–32. doi:10.1007/s11136-021-02814-4. [Google Scholar] [PubMed] [CrossRef]
22. Willis GB. Cognitive interviewing: a tool for improving questionnaire design. Thousand Oaks, CA: Sage Publications; 2005. [Google Scholar]
23. Knafl K, Deatrick J, Gallo A, Holcombe G, Bakitas M, Dixon J, et al. The analysis and interpretation of cognitive interviews for instrument development. Res Nurs Health. 2007;30(2):224–34. doi:10.1002/nur.20195. [Google Scholar] [PubMed] [CrossRef]
24. Bruchez C, Roux P, Santiago Delefosse M. Chapitre 10. Validité et qualité en recherche qualitative : aspects pratiques. In: Santiago Delefosse M, del Rio Carral M, editors. Les méthodes qualitatives en psychologie et sciences humaines de la santé. vol. 225–41. Malakoff, France: Dunod; 2017. [Google Scholar]
25. Carter SL, Wheeler JJ. The social validity manual: subjective evaluation of interventions. 2 ed. London: Academic Press. https://www.sciencedirect.com/science/book/9780128160046. [Accessed 2019]. [Google Scholar]
26. Common EA, Lane KL. Chapitre 4. Social validity assessment. In: Luiselli JK, editor. Applied behavior analysis advanced guidebook. London, UK: Academic Press; 2017. p. 73–92. [Google Scholar]
27. Foster SL, Mash EJ. Assessing social validity in clinical treatment research: issues and procedures. J Consult Clin Psychol. 1999;67(3):308–19. doi:10.1037//0022-006x.67.3.308. [Google Scholar] [PubMed] [CrossRef]
28. Klassen AF, Strohm SJ, Maurice-Stam H, Grootenhuis MA. Quality of life questionnaires for children with cancer and childhood cancer survivors: a review of the development of available measures. Support Care Cancer. 2010;18(9):1207–17. [Google Scholar] [PubMed]
29. Robichaud L-A, Olivier-D’Avignon M, Duval M, Tyo-Gomez M, Leclerc A-A, Michon B, et al. (2023). Quality of life assessment in childhood advanced cancer: development of self-reported versions of advance QoL. International Psycho-Oncology Society (IPOS); Milan, Italy. [Google Scholar]
30. Avoine-Blondin J, Parent V, Lahaye M, Humbert N, Duval M, Sultan S. Identifying domains of quality of life in children with cancer undergoing palliative care: a qualitative study with professionals. Palliat Support Care. 2017;15(5):565–74. doi:10.1017/S1478951516001048. [Google Scholar] [PubMed] [CrossRef]
31. Avoine-Blondin J, Dumont E, Marquis MA, Duval M, Sultan S. Quality of life in childhood advanced cancer: from conceptualization to assessment with the advance QoL tool. BMC Palliat Care. 2022;21(1):138. doi:10.1186/s12904-022-01025-z. [Google Scholar] [PubMed] [CrossRef]
32. Avoine-Blondin J, Parent V, Fasse L, Lopez C, Humbert N, et al. How do professionals assess the quality of life of children with advanced cancer receiving palliative care, and what are their recommendations for improvement? BMC Palliat Care. 2018;17(1):71. doi:10.1186/s12904-018-0328-y. [Google Scholar] [PubMed] [CrossRef]
33. Eiser C. Children’s quality of life measures. Arch Dis Child. 1997;77(4):350–4. [Google Scholar] [PubMed]
34. Huang IC, Wen PS, Revicki DA, Shenkman EA. Quality of life measurement for children with life-threatening conditions: limitations and a new framework. Child Indic Res. 2011;4(1):145–60. doi:10.1007/s12187-010-9079-x. [Google Scholar] [PubMed] [CrossRef]
35. Hinds PS, Menard JC, Jacobs SS. The child’s voice in pediatric palliative and end-of-life care. Prog Palliat Care. 2012;20(6):337–42. doi:10.1179/1743291X12Y.0000000035. [Google Scholar] [CrossRef]
36. Abate C, Lippé S, Bertout L, Drouin S, Krajinovic M, Rondeau É., et al. Could we use parent report as a valid proxy of child report on anxiety, depression, and distress? A systematic investigation of father-mother-child triads in children successfully treated for leukemia. Pediatr Blood Cancer. 2018;65(2):e26840. doi:10.1002/pbc.26840. [Google Scholar] [PubMed] [CrossRef]
37. Weaver MS, Heinze KE, Bell CJ, Wiener L, Garee AM, Kelly KP, et al. Establishing psychosocial palliative care standards for children and adolescents with cancer and their families: an integrative review. Palliat Med. 2016;30(3):212–23. doi:10.1177/0269216315583446. [Google Scholar] [PubMed] [CrossRef]
38. Influence communication. Scolarius: mesurer pour mieux se comprendre. Consultable sur : https://www.scolarius.com. [Accessed 2023]. [Google Scholar]
39. Irwin DE, Varni JW, Yeatts K, DeWalt DA. Cognitive interviewing methodology in the development of a pediatric item bank: a patient reported outcomes measurement information system (PROMIS) study. Health Qual Life Outcomes. 2009;7(1):3. doi:10.1186/1477-7525-7-3. [Google Scholar] [PubMed] [CrossRef]
40. Kazdin A. Social validity. In: Everitt B, Howell D, editors. Encyclopedia of statistics in behavioral science. Hoboken, NJ: Wiley; 2005. p. 1875–6. [Google Scholar]
41. Manne S, Mee L, Bartell A, Sands S, Kashy DA. A randomized clinical trial of a parent-focused social-cognitive processing intervention for caregivers of children undergoing hematopoetic stem cell transplantation. J Consult Clin Psychol. 2016;84(5):389–401. doi:10.1037/ccp0000087. [Google Scholar] [PubMed] [CrossRef]
42. Antunes B, Harding R, Higginson IJ, Euroimpact. Implementing patient-reported outcome measures in palliative care clinical practice: a systematic review of facilitators and barriers. Palliat Med. 2014;28(2):158–75. doi:10.1177/0269216313491619. [Google Scholar] [PubMed] [CrossRef]
43. Carnevale FA. Ethical challenges in pediatric palliative care medicine. Méd Palliative: Soins Support—Accompagnement—Éthique. 2012;11(5):246–51. doi:10.1016/j.medpal.2012.08.001. [Google Scholar] [CrossRef]
44. Carnevale FA. Listening authentically to youthful voices: a conception of the moral agency of children. In: Rodney PA, Starzomski RC, Storch JL, editors. Toward a moral horizon: nursing ethics for leadership and practice. vol. 559, 2 ed. Canada: Pearson; 2012. p. 315–32. [Google Scholar]
45. Gaucher N, Payot A. Focusing on relationships, not information, respects autonomy during antenatal consultations. Acta Paediatrica. 2017;106(1):14–20. doi:10.1111/apa.13590. [Google Scholar] [PubMed] [CrossRef]
46. Walter JK, Ross LF. Relational autonomy: moving beyond the limits of isolated individualism. Pediatrics. 2014;133:16–23. doi:10.1542/peds.2013-3608D. [Google Scholar] [PubMed] [CrossRef]
47. Bluebond-Langner M. The private worlds of dying children. Princeton, NJ: Princeton University Press; 1978. doi: 10.1515/9780691213088 [Google Scholar] [CrossRef]
48. Wangmo T, de Clercq E, Ruhe KM, Beck-Popovic M, Rischewski J, Angst R, et al. Better to know than to imagine: including children in their health care. AJOB Empir Bioethics. 2017;8(1):11–20. doi:10.1080/23294515.2016.1207724. [Google Scholar] [PubMed] [CrossRef]
49. Jordan M, Keefer PM, Lee YA, Meade K, Snaman JM, Kamal A, et al. Top ten tips palliative care clinicians should know about caring for children. J Palliat Med. 2018;21(12):1783–9. doi:10.1089/jpm.2018.0482. [Google Scholar] [PubMed] [CrossRef]
50. Snaman J, McCarthy S, Wiener L, Wolfe J. Pediatric palliative care in oncology. J Clin Oncol. 2020;38(9):954–62. doi:10.1200/JCO.18.02331. [Google Scholar] [PubMed] [CrossRef]
Cite This Article
 Copyright © 2024 The Author(s). Published by Tech Science Press.
Copyright © 2024 The Author(s). Published by Tech Science Press.This work is licensed under a Creative Commons Attribution 4.0 International License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.


 Submit a Paper
Submit a Paper View Full Text
View Full Text Download PDF
Download PDF
 Downloads
Downloads
 Citation Tools
Citation Tools